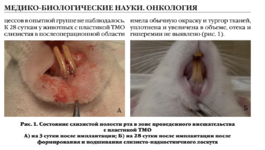
+7 (929) 727 53 60 Травматология / Ортопедия
Клинико-экспериментальное обоснование нового метода хирургического лечения больных с ретенцией нижних третьих моляров
Глава 3. Экспериментальные данные
3.2. Культуральный метод.
В эксперименте на животных мы выявили положительное влияние аллогенного брефоостеоматрикса на регенерацию губчатой кости. Для теоретического обоснования биологических свойств этого костно-пластического материала мы провели эксперименты на культуре клеток дермальных фибробластов крысы.
Такое исследование позволяет изучить прямое действие брефоостеоматрикса на фибробласты (механоциты) – клетки, которые в живом организме принимают непосредственное участие в процессах регенерации. Исследования проводили на дермальных фибробластах крысы 4 – 8 пассажа.
Ход эксперимента. Пассировали клеточную культуру в 2 флакона с 199 средой.
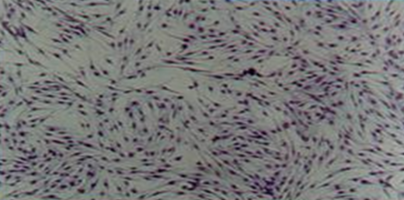
Рис. 14. Культуральный флакон для выращивания фибробластов и культуральные чашки Петри, в которых проводилось исследование брефоостеоматрикса.
Через 48 часов первый флакон культуры оставляли в качестве контрольного, а во второй помещали пластинку брефоматрикса массой 0,3 – 0,5 г. Культивировали клетки в термостате при 37ºС (рис 14). Через четверо суток биопластический материал из второго флакона удаляли и продолжали культивирование еще 2 суток. Нативную культуру исследовали под инвертированным микроскопом "Биолам П-2" при увеличении 150 (окуляр - 15, объектив - 10). Наблюдение производилось ежедневно: оценивали форму и размер клеток, структуру цитолеммы, ядра и ядрышек, положение ядра в клетке. Изучали плотность клеток, время удвоения культуры (время, за которое количество клеток увеличивалось вдвое).
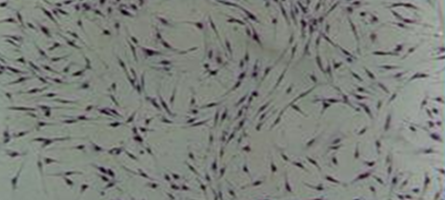
Через сутки нахождения материала во флаконе вокруг кусочка образовывалось поле, лишенное клеток, достаточно правильной округлой формы (рис. 15).
Рис. 15. Зона задержки роста фибробластов вокруг образца материала. Срок-1 сутки. Стрелками указана краевая зона фибробластов вокруг материала и сам материал. Нативная культура. Инвертированный микроскоп. Увеличение 100.
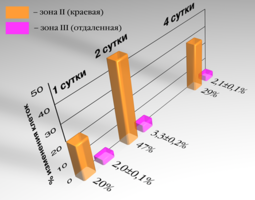
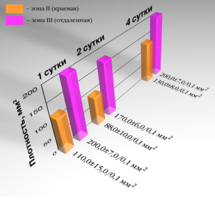
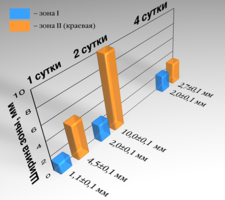
Расстояние от кусочка до границы клеток составляло 1,1±0,1 мм. В краевой зоне плотность клеток составляла 110±15 / 0,1 мм². Большинство фибробластов становились более короткими и широкими, приобретали овальную форму или становились полигональными. У некоторых клеток увеличивалось количество отростков, которые анастомозировали с отростками близлежащих клеток. Цитолемма и нуклеолемма хорошо контурировали. В 20% клеток ядра располагались эксцентрично. Цитоплазма большинства клеток оставалась гомогенной. В ядре, как правило, обнаруживалось одно ядрышко (рис. 16).
Рис.16. Плотный монослой клеток. Срок-1 сутки. Многие фибробласты увеличены в размерах и укорочены. Отростки плохо контурируют. В цитоплазме некоторых клеток видна зернистость. Нативный препарат. Инвертированный микроскоп. Увеличение 100.
Ширина краевой зоны составляла 4,5 ±0,1мм. В отдаленной зоне (далее 4,5 мм) фибробласты имели характерный для культуры вид. Плотность клеток наблюдалась в пределах 200±7 клеток / 0,1 мм².
Через 48 часов расстояние от кусочка исследуемого материала до границы роста клеток возрастала до 2,0±0,1 мм, ширина краевой зоны также увеличивалась – до10±0,1 мм. В краевой зоне 47% клеток имели нечеткие контуры, вакуолизированную цитоплазму и пикнотичные ядра. Плотность их составляла 88±10 клеток / 0,1 мм². На расстоянии 10 мм и более от края кусочка трансплантата только единичные клетки имели вакуоли в цитоплазме. Вид монослоя не отличался от нормального. Плотность клеток составляла 170±6 клеток / 0,1 мм² (рис. 17).
Рис. 17. Уменьшение плотности монослоя на границе краевой и отдаленной зоны. Срок – 2 суток. Фибробласты имеют характерную веретеновидную форму, гомогенную цитоплазму и четко контурирующее ядро. Отростки хорошо выражены. Увеличение 100. Окраска по Романовскому.
На четвертые сутки поле вокруг кусочка исследуемого материала сохраняло форму и размеры. В непосредственной близости от образца появлялись единичные фибробласты. Ширина краевой зоны сокращалась до 2,7±0,2 мм, количество измененных клеток в ней составляло 29 %. Плотность в этой зоне 130±8 клеток / 0,1 мм². (таблица 9).
Таблица 9.
Динамика изменения свойств культуры фибробластов под влиянием брефоостеоматрикса.
В отдаленной зоне вид монослоя и плотность клеток не отличались от нормальных (рис.18, 19, 20).
Рис. 18. Графическое изображение изменений ширины монослоя фибробластов под влиянием брефоостеомарикса на 1е,2е,4е-сутки.
Рис. 19. Графическое изображение изменений плотности монослоя фибробластов под влиянием брефоостеомарикса,1е,2е,4е-сутки.
Рис. 20. Графическое изображение изменений клеточного состава монослоя фибробластов под влиянием брефоостеомарикса на 1е,2е,4е-сутки.
Содержание белковосвязанного оксипролина в ростовой среде составляло 21,49±3,14 мкг/мл, что достоверно отличается от показателей в контрольных экспериментах (2,58±0,01 мкг/мл,). В культуре без воздействия и 3,17±0,01 мкг/мл,) при помещении образца, в культуральную среду без культивируемых фибробластов) и хорошо коррелировало с количеством общего белка (9,3±0,01 г/л, 5,6±0,01 г/л и 4,2±0,01 г/л) соответственно в опыте и в контролях (рис.21).
Рис. 21. Графическое изображение содержания белковосвязанного оксипролина и количество общего белка в опыте и в контролях под влиянием брефоостеомарикса на 4е-сутки.
На четвертые сутки исследуемый материал из флакона был удален. Дальнейшее наблюдение за культурой показало, что уже через 4 часа после удаления брефоостеоматрикса свободное от клеток пространство дна флакона начинало зарастать молодыми фибробластами, имеющими нормальную веретеновидную форму, два или три отростка, светлую цитоплазму и центрально расположенные хорошо контурирующие ядра, содержащие 1-2 ядрышка. На восьмые сутки от начала эксперимента это поле полностью было покрыто монослоем молодых фибробластов с плотностью 200±7 клеток / 0,1 мм² (рис. 22).
Рис. 22. Восстановление плотности монослоя. Срок - 4 суток Фибробласты имеют характерную для нормальных клеток форму, размеры и структуру цитоплазмы и ядра. Окраска по Романовскому. Ув. 100.
Таким образом, результаты нашего исследования показали, что лиофилизированный брефоостеоматрикс способен оказывать прямое стимулирующее влияние на клетки соединительной ткани (фибробласты) в культуре. Это подтверждается усилением синтеза коллагена фибробластами, о чем свидетельствует достоверное повышение содержания белковосвязанного оксипролина в ростовой среде.
-
Оптимизация остеопластичес-кой коррекции атрофирован-ного альвеоляра челюсти. Клинико-экспериментальное исследование
 Цель исследования — разработка но-вого комплекса оперативной коррек-ции атрофированных альвеоляров челюстей для дентальной имплантации и протезирования
Подробнее
Цель исследования — разработка но-вого комплекса оперативной коррек-ции атрофированных альвеоляров челюстей для дентальной имплантации и протезирования
Подробнее
-
Морфологическое и лабора-торное обоснование приме-нения комбинированных трансплантатов при костной пластике челюстей
 Экспериментальное исследование. Изучение морфогенеза после заме-щения дефектов нижней челюсти смесью лиофилизированной алло-спонгиозы и “аллогенного гидроксиапатита” в соотношении 1:1 и 3:1.
Подробнее
Экспериментальное исследование. Изучение морфогенеза после заме-щения дефектов нижней челюсти смесью лиофилизированной алло-спонгиозы и “аллогенного гидроксиапатита” в соотношении 1:1 и 3:1.
Подробнее
-
Эффективность применения биоимплантатов на основе аллогенной деминера-лизованной спонгиозы в детской стоматологии
 Эффективность применения биоимплантатов "Лиопласт-С"® на основе аллогенной деминерализованной спонгиозы при замещении дефектов после удаления одонтогенных кист в у детей
Подробнее
Эффективность применения биоимплантатов "Лиопласт-С"® на основе аллогенной деминерализованной спонгиозы при замещении дефектов после удаления одонтогенных кист в у детей
Подробнее
-
Восстановление структуры кости с помощью аллогенного гидроксиапатита Лиопласт у животных с эксперимен-тальной остеорезорбцией
 Лабораторное исследование. Иньекционный способ введения аллогенного гидроксиапатита полученного при деминерализации костных биоимплантатов для восстановления костной ткани.
Подробнее
Лабораторное исследование. Иньекционный способ введения аллогенного гидроксиапатита полученного при деминерализации костных биоимплантатов для восстановления костной ткани.
Подробнее