+7 (929) 727 53 60 Травматология / Ортопедия
Морфологическое и лабора-торное обоснование приме-нения комбинированных трансплантатов при костной пластике челюстей
В настоящее время актуальным остается вопрос восстановления и сохранения объёма костной ткани при различных операциях на альвеолярных отростках челюстей.
После хирургических вмешательств заживление раны идет под кровяным сгустком с явлениями атрофии костной ткани (Волова Л.Т., 1987).
В зависимости от величины травмы и наличия воспаления процесс регенерации костной ткани, у пациентов в области послеоперационного дефекта альвеолярного отростка завершается в сроки от 4 до 10 месяцев (Фиалко П.Н.,1984; Татинцян В.Г. и соавт., 1989, 1991).
Известны различные формы патологических процессов в альвеолярных отростках челюстей (хронический гранулематозный периодонтит, одонтогенные кистогранулёмы, кисты, пародонтит, различные доброкачественные новообразования), оперативное лечение которых является составной частью реконструктивной хирургии.
Однако и сами по себе эти заболевания, вызывающие увеличение резорбции и образование дефектов кости, равно как и радикальные мероприятия по их устранению, сопровождаются локальными и генерализованными утратами костной ткани (Щепеткин И.А.,1994-1996 г.г.).
В связи с этим особую актуальность приобретает возможность использования при корригирующих операциях средств, воздействующих на течение репаративного остеогенеза (Андриасян Л.Г., 1989; Хафизов А.А., 1994; Модина Т.Н., 1999).
Сегодня применяется довольно большое количество остеопластических материалов, однако все они имеют определенные недостатки.
Остаются крайне актуальными дальнейшие исследования, направленные на выявление, поиск, разработку и обоснование применения остеопластических средств — оптимизаторов остеогенеза — при хирургическом лечении дефектов челюстей (Андриасян Л.Г., 1989; Трунин Д.А., 1988-2007).
Определенный интерес представляют предложения ряда авторов использовать в клинической практике сочетания различных остепластических материалов.
При этом предполагается взаимное положительное влияние их на репаративный остеогенез.
Чаще всего используется смесь костных трансплантатов в соотношении 1:1, реже — 3:1.
Гистологические исследования по данной проблеме единичны и имеют противоречивые результаты.
Учитывая положительные результаты применения в клинической практике лиофилизированной аллогенной губчатой ткани и аллогенного гидроксиапатита, в эксперименте на кроликах нами было проведено изучение морфогенеза после замещения дефектов нижней челюсти смесью лиофилизированной аллоспонгиозы и аллогенного гидроксиапатита в соотношении 1:1 и 3:1.
В качестве контроля использовалась нормальная кость нижней челюсти кролика.
В норме кость нижней челюсти кролика имеет губчатое строение и представлена как компактным пластинчатым, так и губчатым балочным компонентами.
Пластинчатый компонент располагается по периферии на поверхности кости и представлен кортикальной пластиной, имеющей остеонный тип строения.
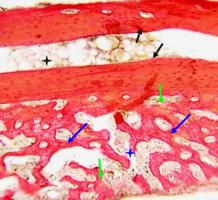
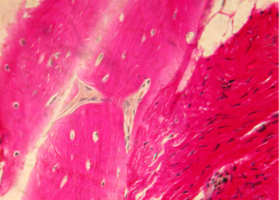
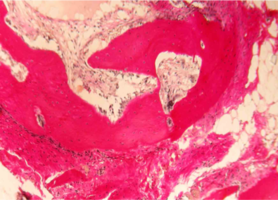
Губчатый компонент, имеющий трабекулярно-балочное строение, расположен внутри под кортикальной пластиной и представлен балками губчатой костной ткани, пространство между которыми заполнено миелоидной тканью, содержащей клетки красного костного мозга, единичными жировыми клетками и сосудами микроциркуляторного русла — капиллярами (рис. 1).
Рис. 1. Строение нижней челюсти кролика в норме
В качестве контроля использовалась нормальная кость нижней челюсти кролика.
В норме кость нижней челюсти кролика имеет губчатое строение и представлена как компактным пластинчатым, так и губчатым балочным компонентами.
Пластинчатый компонент располагается по периферии на поверхности кости и представлен кортикальной пластиной, имеющей остеонный тип строения.
Губчатый компонент, имеющий трабекулярно-балочное строение, расположен внутри под кортикальной пластиной и представлен балками губчатой костной ткани, пространства между которыми заполнены миелоидной тканью, содержащей клетки красного костного мозга, единичными жировыми клетками и сосудами микроциркуляторного русла – капиллярами (рис. 1).
Рис. 1. Строение нижней челюсти кролика в норме. Черными стрелками указан компактный компонент, синими – губчатый.
Между балками губчатого вещества видна миелоидная ткань, клетки жировой ткани и капилляры (указаны зелеными стрелками).
Окраска – пикрофуксин по ван Гизон, х100.
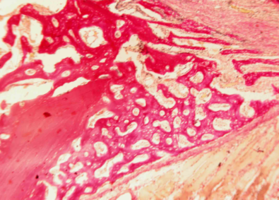
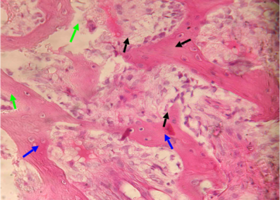
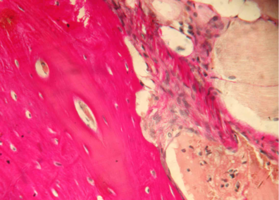
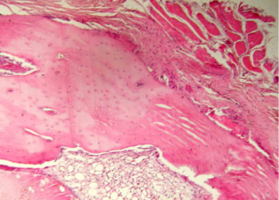
Рис. 2. Нижняя челюсть кролика через 14 суток после остеопластики (аллоспонгиоза:ГАП 1:1)
Репаративные процессы на 14 сутки после пластики костного дефекта смесью лиофилизированной аллоспонгиозы и ГАП 1:1.
На обзорной микрофотографии при малом увеличении (х100) видна зона вмешательства, содержащая имплантированный композит, представляющий собой смесь аллогенных спонгиозы и ГАП (рис. 2).
После проведенной предварительной деминерализации костей нижней челюсти в процессе стандартной гистологической проводки кристаллы ГАП в большинстве своем подвергаются растворению, поэтому не видны на препаратах либо видны лишь в единичных случаях.
На их месте чаще всего обнаруживаются округлой либо овальной формы пустоты в костном веществе имплантированной спонгиозы или в прилежащей к зоне пластики соединительной ткани.
Область вмешательства окружена интактной костью нижней челюсти и прилежащими соединительной и мышечной тканями.
Аллогенная спонгиоза в зоне пластики визуализируется в виде безъядерной субстанции костного строения, имеющей губчато-ячеистую структуру.
Содержит множество округлой, овальной и неправильной формы ячеек, заполненных соединительной тканью.
Костный компонент спонгиозы интенсивно окрашивается в ярко-красный (при окраске пикрофуксином по Ван Гизон) или ярко-розовый (при окраске гематоксилином и эозином) цвет.
Рис. 2. Нижняя челюсть кролика через 14 суток после остеопластики слева, смесь лиофилизированной аллоспонгиозы и ГАП 1:1.
Область пластики, заполненная имплантатом аллогенной спонгиозы, обозначена черными стрелками.
Синими стрелками указана интактная кость.
Окраска - пикрофуксин по ван Гизон, х100.
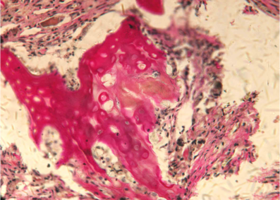
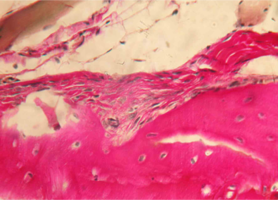
Рис. 3. Нижняя челюсть кролика через 14 суток после остеопластики (аллоспонгиоза:ГАП 1:1)
При большем увеличении (х400) на препаратах отмечается бурная пролиферация клеток соединительной ткани и макрофагально-моноцитарного ростка крови.
Тканевые макрофаги окружают фрагменты спонгиозы и осуществляют их активную резорбцию.
Клетки соединительной ткани (фибробласты) участвуют в синтезе коллагеновых волокон, и активно внедряются в поры и ячейки имплантированного материала (рис. 3).
Рис. 3. Нижняя челюсть кролика через 14 суток после остеопластики слева, смесь лиофилизированной аллоспонгиозы и ГАП 1:1.
Синими стрелками указан фрагмент аллогенной спонгиозы, подвергающийся активному лизису макрофагами (указаны черными стрелками).
Окраска - пикрофуксин по ван Гизон, х400.
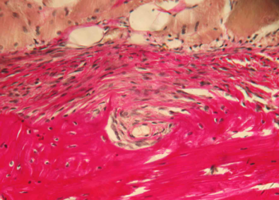
Рис. 4. Нижняя челюсть кролика через 14 суток после остеопластики (аллоспонгиоза:ГАП 1:1)
В толще соединительной ткани определяется интенсивное костеобразование – видны тонкие вновь образованные балки молодой костной ткани, окрашенные более интенсивно, чем интактная кость.
В них определяется резко повышенная клеточность - число клеток (остеобластов) на единицу площади по сравнению с прилежащей зрелой костной тканью нижней челюсти, что подтверждает интенсивность клеточного размножения и пролиферации.
Идет активное новообразование капилляров микроциркуляторного русла, обеспечивающее интенсивное кровоснабжение регенерата (рис. 4).
Рис. 4. Нижняя челюсть кролика через 14 суток после остеопластики слева, смесь лиофилизированной аллоспонгиозы и ГАП 1:1.
Синими стрелками обозначены тонкие новообразованные костные балки, содержащие множество активных остеобластов, указанных черными стрелками.
Зелеными стрелками показаны вновь образованные тонкостенные капилляры.
Окраска - пикрофуксин по ван Гизон, х400.
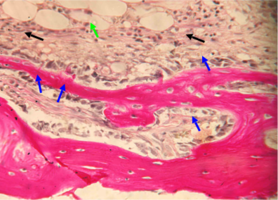
Рис. 5. Нижняя челюсть кролика через 14 суток после остеопластики (аллоспонгиоза:ГАП 3:1)
Репаративные процессы на 14 сутки после пластики костного дефекта смесью лиофилизированной аллоспонгиозы и ГАП 3:1.
При обзорной микроскопии области вмешательства на нижней челюсти кролика справа видна зона пластики, окруженная интактной костью, содержащая как компоненты композита, так и соединительную ткань.
Кристаллы ГАП так же, как и в 1-й серии экспериментов, ввиду предшествующего этапа деминерализации выявляются лишь в единичных случаях.
На их месте видны пустоты различной формы, заполненные небольшим количеством соединительной ткани.
В данной экспериментальной группе отмечается активное формирование сосудов микроциркуляторного русла – в зоне пластики множество тонкостенных капилляров различного диаметра как в толще рыхлой соединительной ткани, так и по краям окружающей зону вмешательства интактной костной ткани и в молодых формирующихся костных балках (рис. 5).
Рис. 5. Нижняя челюсть кролика через 14 суток после остеопластики справа, смесь лиофилизированной аллоспонгиозы и ГАП 3:1.
Синими стрелками указана интактная кость.
В зоне пластики видны фрагменты аллогенной спонгиозы (обозначены черными стрелками).
Зелеными стрелками обозначены пустоты, в некоторых случаях заполненные соединительной тканью, на месте растворившихся кристаллов ГАП.
Окраска - пикрофуксин по ван Гизон, х100.
Рис. 6. Нижняя челюсть кролика через 14 суток после остеопластики (аллоспонгиоза:ГАП 3:1)
При увеличении (х400) в зоне пластики видна структура молодых тонких новообразованных костных балок, отличающихся от интактной кости повышенной клеточностью за счет содержания активных остеобластов.
На периферии вновь образованных костных балок эти клетки зачастую лежат в виде гряды, прилежа к самим балкам.
Как и в 1-й серии опытов, здесь также визуализируются макрофаги, осуществляющие активную резорбцию имплантированного композита и перестройку новообразованных костных балок.
Они располагаются в костных лакунах резорбции и в толще соединительной ткани, имеют вид крупных клеток неправильной, зачастую отростчатой формы, с крупными, интенсивно окрашенными гематоксилином тёмными ядрами и достаточно интенсивно окрашенной темной цитоплазмой (рис. 6).
Рис. 6. Нижняя челюсть кролика через 14 суток после остеопластики справа, смесь лиофилизированной аллоспонгиозы и ГАП 3:1, молодые тонкие новообразованные костные балки (указаны синими стрелками), содержащие активные остеобласты (указаны черными стрелками).
Зелеными стрелками указаны единичные тканевые макрофаги.
Окраска - гематоксилин и эозин, х400.
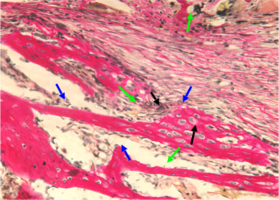
Рис. 7. Нижняя челюсть кролика на 30 сутки после остеопластики (аллоспонгиоза:ГАП 1:1)
Репаративные процессы на 30 сутки после пластики костного дефекта смесью лиофилизированной аллоспонгиозы и ГАП 1:1.
На микропрепаратах отмечается по-прежнему высокий уровень клеточной пролиферации, что подтверждается большим количеством остеобластов во вновь образованных костных балках.
По сравнению с предыдущим сроком (14 суток с момента вмешательства) остаточных фрагментов нерезорбированного композита меньше, молодых костных балок - значительно больше, они становятся более массивными, однако все еще сохраняют строение ретикулофиброзной кости.
Отмечается высокое содержание активных остеобластов как в толще балок, так и по периферии, образующих прилежащие «гряды» клеток.
Соединительная ткань, заполняющая просветы между молодыми костными балками в зоне пластики, полностью сформирована и содержит как клеточный, так и волокнистый компоненты, большое количество капилляров с расширенным просветом.
В толще соединительной ткани отмечается активное формирование и накопление клеток жировой ткани в местах будущего костного мозга (рис. 7).
Рис. 7. Нижняя челюсть кролика на 30 сутки после остеопластики слева, смесь лиофилизированной аллоспонгиозы и ГАП 1:1.
Синими стрелками указаны гряды активных остеобластов в молодых формирующихся костных балках.
Черными стрелками обозначены клетки соединительной ткани (фибробласты), прорастающей между балками.
Зеленой стрелкой указана формирующаяся жировая ткань костного мозга.
Окраска - пикрофуксин по ван Гизон, х400.
Рис. 8. Нижняя челюсть кролика на 30 сутки после остеопластики (аллоспонгиоза:ГАП 3:1)
Репаративные процессы на 30 сутки после пластики костного дефекта смесью лиофилизированной аллоспонгиозы и ГАП 3:1.
При обзорной микроскопии области вмешательства на нижней челюсти кролика справа, как и в 1-й серии опытов, остается значительно меньше остаточных фрагментов имплантированного месяц назад композита, видно большое количество молодых капилляров в соединительной ткани и в толще молодых костных балок.
Интенсивно идут процессы клеточной и тканевой регенерации, что подтверждается наличием большого числа остеобластов (высокая клеточность) в активно формирующихся костных балках и их яркой окраской.
Активно идет формирование рыхлой волокнистой соединительной ткани, окружающей балки и представленной молодыми, тонкими, извитыми и ярко окрашенными коллагеновыми волокнами с большим количеством фибробластов (рис. 8).
Рис. 8. Нижняя челюсть кролика на 30 сутки после остеопластики справа, смесь лиофилизированной аллоспонгиозы и ГАП 3:1.
Синими стрелками указаны активные остеобласты в молодых формирующихся костных балках.
Черными стрелками обозначена прилежащая к балкам соединительная ткань, зеленой стрелкой – мышечная ткань.
Окраска - пикрофуксин по ван Гизон, х400.
Рис. 9. Нижняя челюсть кролика на 90 сутки после остеопластики (аллоспонгиоза:ГАП 1:1)
Репаративные процессы на 90 сутки после пластики костного дефекта смесью лиофилизированной аллоспонгиозы и ГАП 1:1.
Микроскопически видно некоторое снижение уровня клеточной пролиферации - клеточность молодых костных балок на данном этапе ниже, чем на предыдущих сроках (спустя 14 и 30 суток с момента операции).
Остаточные фрагменты имплантированного композита в зоне пластики отсутствуют.
Новообразованные костные балки становятся шире, массивнее.
Отмечается формирование очагов зрелой пластинчатой кости среди преобладающей основной массы незрелой провизорной ретикулофиброзной костной ткани.
Содержание активных остеобластов снижается за счет превращения основной их массы в зрелые остеоциты.
Просветы между костными балками заполнены извитыми волокнами молодой соединительной и мышечной тканей, а также участками жировой ткани, содержащей отдельные клетки костного мозга.
Отмечается активный рост и формирование сосудов как в толще самих балок, так и в окружающих их соединительной, мышечной и жировой тканях (рис. 9).
Рис. 9. Нижняя челюсть кролика на 90 сутки после остеопластики слева, смесь лиофилизированной аллоспонгиозы и ГАП 1:1.
Синими стрелками указаны остеоциты в молодых костных балках, черными – сосуды, зелеными стрелками – тонкие извитые коллагеновые волокна рыхлой соединительной ткани, желтой стрелкой – клетки жировой ткани.
Окраска - пикрофуксин по ван Гизон, х400.
Рис. 10. Нижняя челюсть кролика на 90 сутки после остеопластики (аллоспонгиоза:ГАП 3:1)
Репаративные процессы на 90 сутки после пластики костного дефекта смесью лиофилизированной аллоспонгиозы и ГАП 3:1.
При микроскопическом исследовании зоны пластики в нижней челюсти кролика справа, как и в 1-й серии опытов, остаточных фрагментов имплантированного три месяца назад композита не выявляется.
Продолжаются процессы клеточной и тканевой регенерации, но клеточная пролиферация менее активна, по сравнению с предыдущими сроками видно снижение клеточности костных балок, превращение основной массы активных остеобластов в зрелые остеоциты и наличие отдельных участков трансформации незрелой провизорной ретикулофиброзной костной ткани в зрелую пластинчатую.
Продолжается активное формирование рыхлой волокнистой соединительной ткани, окружающей балки и представленной молодыми, тонкими, извитыми и ярко окрашенными коллагеновыми волокнами с большим количеством фибробластов.
Сохраняется интенсивное кровоснабжение зоны регенерата за счет формирования большого количества сосудов микроциркуляторного русла в соединительной ткани и в толще молодых костных балок (рис. 10).
Рис. 10. Нижняя челюсть кролика на 90 сутки после остеопластики справа, смесь лиофилизированной аллоспонгиозы и ГАП 3:1.
Синими стрелками указаны остеоциты в молодых костных балках, черными – сосуды, зелеными стрелками – тонкие извитые коллагеновые волокна рыхлой соединительной ткани, желтыми стрелками – клетки жировой ткани.
Окраска - пикрофуксин по ван Гизон, х400.
Рис. 11. Нижняя челюсть кролика на 150 сутки после остеопластики (аллоспонгиоза:ГАП 1:1)
Репаративные процессы на 150 сутки после пластики костного дефекта смесью лиофилизированной аллоспонгиозы и ГАП 1:1.
Продолжаются процессы регенерации, однако их интенсивность гораздо ниже, чем на предыдущих сроках.
Это выражается снижением клеточности молодых костных балок, их трансформацией в компактный и губчатый компоненты зрелой кости, между трабекулами которого видна сформированная ячеистая жировая ткань, содержащая клетки костного мозга.
Костная ткань представлена зрелыми остеоцитами, замурованными в ее основном веществе.
Активные остеобласты в незначительном количестве расположены преимущественно по периферии балок и между трабекулами губчатого компонента.
В зоне регенерата видны пучки молодых извитых коллагеновых волокон соединительной ткани.
Сохраняется достаточно высокая клеточность ее основного вещества.
Клетки представлены преимущественно фибробластами, но часть из них уже трансформировалась в более зрелые формы – фиброциты.
Мышечные волокна в области регенерата имеют нормальную толщину, типичную исчерченность с расположением ядер по периферии и направление хода, что говорит об их полном восстановлении после перенесенной операции.
Сосуды микроциркуляторного русла отмечаются примерно в том же количестве, что и в интактной кости, их просвет не расширен и соответствует норме (рис. 11).
Рис. 11. Нижняя челюсть кролика на 150 сутки после остеопластики слева, смесь лиофилизированной аллоспонгиозы и ГАП 1:1.
Синими стрелками указаны остеоциты в костных балках, черными стрелками – тонкие извитые коллагеновые волокна рыхлой соединительной ткани, зелеными стрелками – клетки жировой ткани, желтой стрелкой – зрелое мышечное волокно.
Окраска - пикрофуксин по ван Гизон, х400.
Рис. 12. Нижняя челюсть кролика на 150 сутки после остеопластики (аллоспонгиоза:ГАП 3:1)
Репаративные процессы на 150 сутки после пластики костного дефекта смесью лиофилизированной аллоспонгиозы и ГАП 3:1.
В данной опытной серии микроскопическая картина сходна с наблюдаемой в группе экспериментов после имплантации в костный дефект смеси спонгиозы и ГАП 1:1.
Процессы регенерации сохраняются, но идут меньшей интенсивностью, чем на предыдущих сроках.
Костная ткань по своему строению практически полностью представлена зрелой пластинчатой костью, состоящей из компактного и губчатого компонентов с наличием жировой и миелоидной ткани между трабекулами.
Интенсивность регенерации в зоне регенерата в основном сохраняется лишь в соединительной ткани, содержащей достаточно высокое количество молодых активных фибробластов.
Мышечные волокна имеют вид и структуру интактных.
Капилляры в рассматриваемой области имеют нормальную толщину стенок и просвет, их количество также примерно соответствует норме (рис. 12).
Рис. 12. Нижняя челюсть кролика на 150 сутки после остеопластики справа, смесь лиофилизированной аллоспонгиозы и ГАП 3:1.
Синими стрелками указаны остеоциты в костных балках, черными стрелками – тонкие извитые коллагеновые волокна рыхлой соединительной ткани, зелеными стрелками – клетки жировой ткани, желтыми стрелками – зрелые мышечные волокна.
Белой стрелкой указан единичный капилляр в толще молодой костной ткани на ее границе с соединительной.
Окраска - пикрофуксин по ван Гизон, х400.
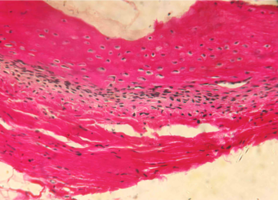
Рис. 13. Нижняя челюсть кролика на 270 сутки после остеопластики (аллоспонгиоза:ГАП 1:1)
Репаративные процессы на 270 сутки после пластики костного дефекта смесью лиофилизированной аллоспонгиозы и ГАП 1:1.
На данном сроке микроскопическая картина регенерата идентична нормальной, здоровой интактной кости.
Полностью сформированы компактный и губчатый компоненты нижней челюсти с заполненными жировой и миелоидной тканями пространствами между трабекулами губчатого вещества.
Преобладающая масса клеток – остеоциты. Однако процессы регенерации полностью не завершены.
Их активность сопоставима с активностью при текущей физиологической регенерации.
Активные остеобласты обнаруживаются в небольших количествах лишь по периферии зоны регенерата и по краям костных балок в виде «гряд» клеток.
Соединительная и мышечная ткани по структуре идентичны таковым у интактных кроликов (рис. 13).
Капилляров обычное количество, их просвет не расширен, толщина стенки в норме, что свидетельствует об уровне кровоснабжения, сопоставимом с интактной тканью.
Рис. 13. Нижняя челюсть кролика на 270 сутки после остеопластики слева, смесь лиофилизированной аллоспонгиозы и ГАП 1:1.
Синими стрелками указаны остеоциты в костных балках, черными стрелками – гряда активных остеобластов по периферии кости, зелеными стрелками – жировая и миелоидная ткани между трабекулами губчатого вещества кости, белыми стрелками – единичные сосуды.
Окраска - пикрофуксин по ван Гизон, х100.
Рис. 14. Нижняя челюсть кролика на 270 сутки после операции (аллоспонгиоза:ГАП 3:1)
Репаративные процессы на 270 сутки после пластики костного дефекта смесью лиофилизированной аллоспонгиозы и ГАП 3:1.
В данной опытной серии отмечается схожесть морфологической картины зоны регенерата с первой серией экспериментов, т.е. также отмечается полное восстановление структуры костной, соединительной и мышечной тканей в месте бывшего вмешательства с сохранением интенсивности регенераторных процессов на уровне текущей физиологической регенерации (рис. 14).
Рис. 14. Нижняя челюсть кролика на 270 сутки после операции справа, смесь лиофилизированной аллоспонгиозы и ГАП 3:1.
Синими стрелками указаны остеоциты в костных балках, черными стрелками – компоненты соединительной, желтыми – мышечной тканей.
Зелеными стрелками показана жировая и миелоидная ткани между трабекулами губчатого вещества кости, белыми стрелками – единичные сосуды.
Окраска - гематоксилин и эозин, х100.
Выводы проведенной работы и оценка результатов
Таким образом, на 14-е сутки (рис. 2-6) после пластики костных дефектов нижней челюсти разным составом смесей аллогенных спонгиозы и ГАП регенерация идёт примерно с одинаковой интенсивностью в обоих экспериментальных сериях.
Это подтверждается высоким количеством вновь образованных костных балок, большой их клеточностью за счет повышенного содержания активных остеобластов, участвующих в синтезе основного вещества кости.
Наблюдается активное рассасывание трансплантата, на что указывает наличие макрофагов, образующих лакуны резорбции в спонгиозе.
Через 30 суток после операции в обеих сериях эксперимента сохраняется высокий уровень клеточной пролиферации, что подтверждается большим количеством остеобластов как в толще вновь образованных костных балок, так и по их периферии, образующих прилежащие «гряды» клеток, увеличением количества самих балок.
Соединительная ткань, заполняющая просветы между костными балками в зоне пластики, полностью сформирована и содержит как клеточный, так и волокнистый компоненты, а также большое количество капилляров с расширенным просветом.
В толще соединительной ткани отмечается активное формирование и накопление клеток жировой ткани в местах будущего костного мозга. Остаточных фрагментов не резорбированного композита становится значительно меньше.
Через 90 суток после операции в обеих опытных сериях продолжается активное формирование и созревание рыхлой неоформленной соединительной ткани с образованием жировой ткани, содержащей единичные клетки костного мозга, что является этапом формирования костного мозга.
Основная масса остеобластов превращается в остеоциты. Имплантированный костный материал не определяется.
На 150 и 270 сутки после операции в обеих сериях опытов отмечается полное восстановление костной, соединительной и мышечной тканей в зоне бывшего операционного вмешательства.
Костная ткань представлена полноценными компактным и губчатым компонентами.
Между балками губчатого вещества новообразованной зрелой кости так же, как и в интактной, содержатся жировая и миелоидная ткани с кроветворными клетками.
Соединительная ткань представлена зрелыми коллагеновыми, мышечная – зрелыми мышечными волокнами, имеющими упорядоченный ход и структуру.
Количество капилляров, толщина их стенок и диаметр просвета идентичны таковым в интактной ткани.
Итак, перестройка костных имплантатов лиофилизированной аллоспонгиозы и “аллогенного гидроксиапатита” в соотношении 1:1 и 3:1 протекает практически идентично.
Образование новой костной ткани у кроликов в основном завершается 150 сутки после операции, при этом формируется органотипичный регенерат.
К 270 суткам в зоне остеопластики сохраняется нормальная структура костной ткани.
Микробиологическое обоснование профилактики воспалительных осложнений
Микробиологическое обоснование профилактики воспалительных осложнений при костной пластике челюстей по способу автора.
Одной из важнейших проблем после костной пластики челюстей является профилактика воспалительных осложнений.
Это обусловлено наличием одонтогенных очагов инфекции в челюстно-лицевой области, многообразием микробных штаммов возбудителей, их высокой резистентностью к известным антибиотикам, высокой аллергализацией населения.
Учитывая слабую устойчивость лиофилизированной аллоспонгиозы к инфекции, мы предприняли попытку к разработке лекарственного комплекса антимикробного действия для насыщения аллоспонгиозы во время оперативного вмешательства с помощью низкочастотного ультразвука..
С этой целью костные трансплантаты, насыщенные с помощью ультразвука различными химиотерапевтическими препаратами, помещали поверх посева микроорганизмов в чашки Петри.
Чашки с посевами бактерий инкубировали в термостате при to 37oC в течение суток, а с посевами дрожжеподобных грибов Candida albicans - в термостате при to 30oC в течение 2х суток.
Затем измерялась зона задержки роста микроорганизмов вокруг кусочка костного трансплантата.
Наличие такой зоны свидетельствовало об антимикробном действии препарата, содержащегося в костном трансплантате, а размер зоны отсутствия роста позволял судить о степени выраженности антимикробного действия препарата.
Антибактериальное и противогрибковое действие костных трансплантатов, насыщенных химиотерапевтическими препаратами с помощью ультразвука в течение 1 минуты.
|
Препараты тест- кульруры |
Хлор- гексидин |
Диок- сидин |
Хлор- гексидин +конус |
Неомицин (контроль) |
Хлор- гексидин +гентамицин |
Гента- мицин (контроль) |
Хлор- гексидин +офлоксацин |
Офлок- сацин (контроль) |
Хлор- гексидин +нистатин |
Бутол |
Амфо- терицин В (контроль) |
|
Staphylococcus anreus |
12 | 0 | 20 | 25.26 | 35 | 30.35 | 36 | 30.35 | 17 | 18.22.24 | __ |
|
Escherichia coli |
20 | 0 | 16 | 25.26 | 26 | 30.35 | 30 | 30.35 | 15 | 16.16.16 | __ |
|
Candida albicans |
0 |
0 | 0 | 0 | 0 | 0 | 0 | 0 | 26 | 0 | 25 |
Полученные результаты позволяют сделать вывод о наибольшей эффективности действия против бактерий у сочетаний хлоргексидина с гентамицином и офлокцином.
Контрольные посевы тест-культур бактерий с наложением стандартных бумажных дисков, содержащих гентамицин и офлоксацин, выявили такую же эффективность этих препаратов, как и при изучение действия насыщенных костных трансплантатов.
Следовательно, количество гентамицина и офлаксацина в кусочке кости при её насыщении ультразвуком не менее 30 мкг, как и в бумажном диске.
Добавление хлоргексидина к гентамицину и офлоксацину не увеличивает эффективности этих композиций против бактерий.
Противогрибковым действием обладает из испытанных препаратов только амфотерицин В.
В контрольных посевах с использованием стандартных бумажных дисков с антибиотиками эффективность амфотерицин В такая же, как при сочетании амфотерицина В с хлоргексидином.
Следовательно, хлоргексидин на активность амфотерицин В не влияет.
Можно отметить так же, что антибактериальное действие хлоргексидина в концентрациях от 2% до 20% совершенно одинаковое.
Более низкие концентрации хлоргекидина оказывают менее выраженное действие на тест-культуры Escherichia coli и Staphylococcus anreus.
Следовательно, хлоргексидин желательно использовать в концентрации не менее 2%.
Антибактериальная активность хлоргексидина в разных концентрациях
Зоны задержки роста тест-микробов
|
Концентрация хлогексидина, % |
Staphylococcus aureus, мм |
Escherichia coli, мм |
| 20 | 20 | 18 |
| 15 | 20 | 18 |
| 10 | 20 | 18 |
| 5 | 20 | 18 |
| 4 | 20 | 18 |
| 3 | 20 | 18 |
| 2 | 20 | 18 |
| 1 | 18 | 14 |
| 0,5 | 18 | 12 |
Исходя из полученных результатов, можно использовать для насыщения костных трансплантатов гентамицин или офлаксацин в сочетании с хлоргексидином.
Однако, учитывая, что в полости рта обнаруживают не только аэробные или факультативноанаэробные микроорганизмы, но и облигатноанаэробные, мы решили подобрать антибиотик, эффективный против бактерий с любым типом дыхания.
Таким действием обладает амоксиклав.
Определение антибактериальной активности амоксиклава и бутола проводили уже описанным выше способом после насыщения костных трансплантатов без действия ультразвука, с применением ультразвука в течение 1 минуты и 2 минут.
Антимикробное действие трансплантатов с применением ультразвука и без него
|
St. aureus Сразу после насыщениятрансплатата |
St. aureus Через неделю после насыщения |
St. aureus Через две недели после насыщения |
Е. coli Сразу после насыщения трансплантата |
Е. coli Через неделю после насыщения |
Е. coli Через две недели после насыщения |
|
|
Амоксиклав+бутол+дексаметазон. Озвучивание 1` |
38 | 37,39 | 30 | 16 | 14,15 | 10 |
|
Амоксиклав+бутол+дексаметазон 1` без озвучивания |
30 | 30,28 | 30 | 15 | 15,16 | 11 |
|
Амоксиклав+бутол озвучивание 1` |
34 | 33,33 | 24 | 11 | 9,10 | 8 |
|
Амоксиклав+бутол 1` без озвучивания |
34 | 32,34 | 30 | 12 | 10,11 | 7 |
|
Бутол озвучивание 2` |
22 | 20,21 | 15 | 16 | 15,17 | 13 |
|
Бутол без озвучивания2` |
15 | 15,16 | 12 | 15 | 14,15 | 11 |
|
Бутол без озвучивания2` |
20 | 20,22 | 16 | 16 | 13,16 | 13 |
|
Бутол без озвучивания 1` |
24 | 22,21 | 16 | 16 | 14,15 | 10 |
|
Контроль: -амоксиклав (стандартный диск) -бутол – 0,01 мл |
34 24 |
____ ____ |
____ ____ |
16 16 |
____ ____ |
____ ____ |
Из данной таблицы видно, что наиболее эффективным антимикробным действием обладают костные трансплантаты, озвученные в течение одной минуты с использованием комплекса лекарственных препаратов амоксиклав, бутол и дексаметазон.
Антибактериальная активность насыщенных костных трансплантатов сохраняется на протяжении двух недель. Антигрибковая активность у испытанных препаратов отсутствует.
В связи с этим к данному лекарственному комплексу, обладающему высокой антибактериальной активностью, с целью подавления роста грибов необходимо добавлять амфотерицин В.
-
Эффективность применения биоимплантатов на основе аллогенной деминера-лизованной спонгиозы в детской стоматологии
 Эффективность применения биоимплантатов "Лиопласт-С"® на основе аллогенной деминерализованной спонгиозы при замещении дефектов после удаления одонтогенных кист в у детей
Подробнее
Эффективность применения биоимплантатов "Лиопласт-С"® на основе аллогенной деминерализованной спонгиозы при замещении дефектов после удаления одонтогенных кист в у детей
Подробнее
-
Восстановление структуры кости с помощью аллогенного гидроксиапатита Лиопласт у животных с эксперимен-тальной остеорезорбцией
 Лабораторное исследование. Иньекционный способ введения аллогенного гидроксиапатита полученного при деминерализации костных биоимплантатов для восстановления костной ткани.
Подробнее
Лабораторное исследование. Иньекционный способ введения аллогенного гидроксиапатита полученного при деминерализации костных биоимплантатов для восстановления костной ткани.
Подробнее
-
Ранняя и отсроченная дентальная имплантация после удаления зубов с аллогенными остеопластическими материалами Лиопласт
 Клинико-экспериментальное исследование. Эффективность лечения больных с вторичной адентией в ранние сроки после удаления зубов с использованием новых конструкций дентальных имплантатов.
Подробнее
Клинико-экспериментальное исследование. Эффективность лечения больных с вторичной адентией в ранние сроки после удаления зубов с использованием новых конструкций дентальных имплантатов.
Подробнее
-
Эффективность применения аллогенной деминерализованной спонгиозы «Лиопласт-С»® в детской и взрослой стоматологии
 Клинико-экспериментальное иссле-дование. Оценка эффективности использования деминерали-зованной спонгиозы "Лиопласт-С"® при лечении альвеолитов и зубо-содержащих кист у детей и взрослых
Подробнее
Клинико-экспериментальное иссле-дование. Оценка эффективности использования деминерали-зованной спонгиозы "Лиопласт-С"® при лечении альвеолитов и зубо-содержащих кист у детей и взрослых
Подробнее