+7 (929) 727 53 60 Травматология / Ортопедия
Клиническое обоснование дифференцированного применения различных имплантационных материалов в стоматологии
1. ВВЕДЕНИЕ.
1. 1. Актуальность исследования.
В последнее десятилетие имплантация искусственных зубов в стоматологии стала занимать достаточно прочное место в ряду основных стоматологических мероприятий.
Разработка научно-обоснованной теоретической базы дентальной имплантации, совершенствование различных систем дентальных имплантатов как в нашей стране, так и за рубежом, анализ большого объема клинического материала в ведущих клиниках мира позволяют утверждать, что эти мероприятия могут решить часть проблем реабилитации больных с дефектами зубных рядов [8, 88, 181, 215, 238, 249, 255, 273, 298, 347].
Весь накопленный научно-практический потенциал в достаточно широких клинических пределах реализует желание пациентов пользоваться несъемными зубными протезами, даже при значительной потери зубов [73, 250, 362, 429].
В то же время, несмотря на ряд очевидных преимуществ, имплантация для пациентов представляет в определенной степени риск, так как конечный результат и прогноз зависит от сложного комплекса взаимодействующих факторов: медико-биологических, физических, механических и др. [72,184,197, 234,263, 282,363,392,402].
Исследования в современной дентальной имплантологии ведутся в нескольких направлениях.
Основными являются: изучения процессов остеоинтеграции, расширение показаний к данному методу лечения, создание широкого ассортимента зубных имплантатов из различных биосовместимых материалов, совершенствование собственно методик имплантации с привлечением средств улучшающих процесс остеоинтеграции, полноценная ортопедическое лечение.
Конечной целью всех этих мероприятий является полноценная реабилитация пациентов с частичной или полной потерей зубов [22, 117, 167, 176, 212, 223, 393, 402].
Другим, не менее важным, направлением имлантологии является разработка методологии лабораторного анализа оценки безопасности, качества и эффективности биопластических материалов и других изделий медицинского назначения с помощью клеточных биотехнологий.
Согласно Российскому законодательству и Всемирному этическому кодексу врачей, каждый инновационный проект в области медицины предполагает обязательные и всесторонние доклинические испытания новых препаратов, факторов и способов лечения пациентов на живых системах (in vivo и vitro).
Среди них на текущий момент исследования с использованием культур клеток, являются наиболее этичными.
Существующие нормативы и стандарты лабораторных испытаний изделий медицинского назначения и лекарственных средств, включают исследования in vitro на клетках.
Однако в основном они используются для оценки цитотоксичности испытуемых объектов (ГОСТ ИСО) [119].
Вместе с тем современный уровень клеточных биотехнологий, принципы биоэтики и требования GLP — «хорошая лабораторная техника» — делают применение клеточных культур в этой области медицины чрезвычайно актуальным.
Такой подход к совершенствованию имплантологии вполне оправдан, так как частичная и полная потеря зубов наряду с кариесом и болезнями пародонта становится наиболее частой патологией зубочелюстной системы [60].
По данным ВОЗ, потерей зубов страдает до 75% населения земного шара.
Анализ состояния стоматологической помощи в нашей стране показывает, что потеря зубов составляет от 40 до 75% [147].
Сегодня становится совершенно очевидно, что дефекты зубных рядов, неадекватно компенсированные съемным протезированием, приводят не только к нарушению функции зубочелюстной системы, атрофии альвеолярных костей, но и к нарушению функций ряда систем организма человека, включая психоэмоциональное состояние.
В то же время результаты, полученные зарубежными и некоторыми отечественными учеными, доказывают, что проведение ортопедического лечения с использованием имплантатов представляет достаточно сложную задачу, поскольку существует целый ряд проблем, решение которых еще предстоит осуществить [144, 243, 262].
В специальной литературе мало сведений о характере и типе остеоинтеграции в зависимости от применяемого имплантата.
Большие сложности с оценкой в клинике состояния параимплантатной костной ткани, а также сроков ее дифференцировки.
Мало данных об особенностях ведения послеоперационного периода.
Почти нет сведений об особенностях и различиях в механизмах остеоинтеграции при непосредственной и отсроченной имплантации.
Немногочисленны и противоречивы данные о возможности применения остеоиндуктивных биодеградирующих составов для направленной регенерации параимплантатных участков альвеолярной кости человека и интеграции имплантата.
В связи с этим, на наш взгляд, представляет определенный теоретический и практический интерес разработка комплекса мероприятий для лечения частичной или полной потери зубов с использованием имплантатов.
Мы считаем, что такой комплекс мероприятий должен состоять из трех основных этапов.
На первом проводятся диагностические и санационные мероприятия, исследование как общего состояния пациента, так и состояния имплантационного ложа, составление математических моделей, позволяющих прогнозировать как наиболее рациональный способ имплантационного вмешательства, так и последующее ортопедическое лечение.
На втором, хирургическом этапе, представляет интерес исследование репаративных процессов в альвеолярной кости при непосредственной и отсроченной имплантации с применением остеоиндуктивных материалов, разработка методов, качественно улучшающих ведение послеоперационного периода при дентальной имплантации.
На третьем, ортопедическом, — разработка и внедрение новых ортопедических приемов протезирования на имплантатах.
При этом необходимо помнить, что конечной целью лечения потери зубов с помощью имплантатов является не блестяще выполненная операция дентальной имплантации, а изготовление протезной конструкции, помогающей существенно улучшить качество жизни пациента.
1. 2. Цель исследования.
Клинико-экспериментальное обоснование дифференцированного применения имплантационных материалов для повышения эффективности и качества стоматологической помощи больным с различными формами частичной и полной потери зубов.
1. Задачи исследования:
- В эксперименте изучить реакцию клеточных культур (фибробластов) на различные костнозамещающие материалы.
- В эксперименте изучить реакцию клеточных культур (фибробластов) на различные образцы дентальных имплантатов и возможность повторного использования имплантатов при реимплантации.
- Провести сравнительную характеристику остеорепаративных средств на основе синтетического и аллогенного гидроксиапатита кальция в зависимости от выраженности остеогенного потенциала.
- Разработать методы, повышающие эффективность рентгенологической диагностики.
- Разработать и обосновать клинические показания к применению винтовых имплантатов с использованием биорезорбируемых материалов.
- Изучить эффективность имплантационного лечения больных, с использованием остеорепаративных средств в отдаленном периоде.
- На основании полученных данных разработать практические рекомендации по использованию имплантационных материалов в стоматологической практике.
1. 4 .Научная новизна исследования.
В эксперименте получены данные о высокой эффективности использования клеточных культур в качестве среды для тестирования различных имплантационных материалов.
Получены новые данные о реакции культур фибробластов на различные виды гидроксиапатита, а также на металлические фрагменты имплантатов (новые и бывшие в употреблении).
Установлено, что наиболее выраженным остеотропным потенциалом обладают остеорепаративные средства на основе аллогенного гидроксиапатита, препараты на основе синтетического гидроксиапатита являются преимущественно биоинертными.
Впервые установлено, что использование недеминерализованной спонгиозы и аллогенного гидроксиапатита (серии «Лиопласт»®) ускоряет остеоинтеграцию костной ткани альвеолярного отростка на 35% по сравнению с контрольной группой, увеличивает эффективность использования имплантатов, устанавливаемых одномоментно и при реимплантации, что позволяет сократить время начала нагрузки на установленные имплантаты, в среднем в 1,4 раза.
Впервые установлено, что использование дентальных имплантатов в комбинации с недеминерализованной спонгиозой и аллогенным ГАП сокращает количество осложнений на 54,5% по сравнению с контрольной группе.
1. 5. Положения, выносимые на защиту.
- Новая экспериментальная модель для изучения свойств имплантационных материалов.
- Метод диагностического обследования, позволяющий адекватно оценить зону оперативного вмешательства.
- Методики хирургической тактики применения методов направленной регенерации челюстных костей в зависимости от клинической ситуации.
- Алгоритм рациональной реабилитации больных с различными формами дефектов зубных рядов.
1.6. Практическая значимость результатов исследования
Получены новые данные об эффективности использования аллогенного гидроксиапатита и недеминерализованной спонгиозы для ускорения репаративных процессов костной ткани альвеолярного отростка в области установки дентальных имплантатов.
Разработан метод, позволяющий повысить эффективность такого обследования, как ортопанрентгенография.
Разработаны показания и противопоказания к применению методов непосредственной и отдаленной дентальной имплантации с использованием биорезорбируемых средств, позволяющие значительно повысить эффективность лечения больных.
В практическую деятельность лечебных учреждений введен метод непосредственной и ранней отсроченной дентальной имплантации с использованием аллогенного ГАП и недеминерализованной спонгиозы.
Клинически обоснован и рекомендован к широкому применению в практике метод комплексного предоперационного обследования пациентов.
1. 7. Внедрение в практику результатов исследования.
Апробация работы. Основные материалы диссертации докладывались и обсуждались: на научно-практических семинарах «Опыт и перспективы клинического применения имплантатов «Конмет» (Москва, 2002, 2003, 2004, 2005, 2006), на 35 и 38, 39 научно-практических конференциях стоматологов Ставропольского края «Актуальные проблемы стоматологии» (Ставрополь, 2004, 2005, 2006), на Всероссийском стоматологическом форуме «Актуальные вопросы клинической стоматологии» (Воронеж, 2005), на Всероссийском форуме «Современная стоматология 2005» (Ростов-на-Дону, 2005), на Всероссийской научно-практической конференции «Новые технологии в стоматологии» (Ростов-на-Дону, 2006), на VIII Ежегодном научном форуме «Стоматология 2006» (Москва 2006), на VII Всероссийском Конгрессе по дентальной имплантологии «Дентальная имплантология как способ расширения ортопедических возможностей при лечении потери зубов» (Пятигорск 2007), на Всероссийской конференции с международным участием «Инновационные технологии в трансплантации органов, тканей и клеток», посвященной 25-летию Самарского банка тканей и 45-летию ЦНИЛ Самарского государственного медицинского университета (Самара, 2008).
1.8 Публикации.
По теме диссертации опубликованы: 30 научных работ, из них 8 работ в изданиях, рекомендованных ВАК, издано 3 учебно-методических пособия. Оформлено 3 изобретения.
1.9. Объем и структура диссертации
Диссертация изложена на 239 страницах, состоит из введения, обзора литературы, 4 глав собственных исследований, заключения, выводов, практических рекомендаций, списка литературы, включающего 439 источников, из них 123 работы — иностранных авторов и 316 — отечественных. Работа иллюстрирована 127 рисунками и содержит 24 таблицы.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
ГЛАВА ii.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ.
3.1. Материалы и методы экспериментального исследования.
Основной целью экспериментального исследования являлось изучение реакции культуры фибробластов на различные виды гидроксиапатита.
Объектами исследования явились образцы синтетического гидроксиапатита (пористой гидроксиапатитной керамики производства предприятия «Фихимед», г. Ставрополь), образцы кристаллического материала минерального компонента костной ткани - так называемый «аллогенный гидроксиапатит» (кортикальная кость) и недеминерализованная спонгиоза (губчатая кость) получаемые по технологии «Лиопласт».
Разработанный и запатентованный нами метод экологически чистого, безотходного производства биоимплантатов из костной ткани позволяет одновременно получать деминерализованные имплантаты и «аллогенный гидроксиапатит», содержащий весь комплекс микроэлементов неорганической составляющей кости.
Сам минеральный имплантат представляет собой щелочной материал.
В Самарском тканевом банке ЦНИЛ разработан комплексный метод оценки морфофункционального состояния коллагенсинтезирующих культур клеток в условиях имплантации различных биопластических материалов.
Исследование проведено на первичных культурах дермальных фибробластов и мезенхимальных стромальных клетках человека 4-12 пассажа.
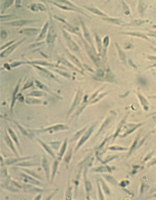
Культуру дермальных фибробластов получали из кожно-мышечной ткани, а культуру мезенхимальных стромальных клеток – из фрагментов крыши черепа абортусов сроком 6-10 недель методом первичных эксплантатов (рис. 1, 2).
Такие клетки по отношению к тестируемым биоимплантатам из костной ткани человека являются аллогенными, так как принадлежат разным особям одного и того же вида.
Клетки культивировали в стандартных условиях в термостате Sanyo – Incubator MIR-262 при температуре 37°С в среде МЕМ с 10% эмбриональной телячьей сыворотки в пластиковых культуральных флаконах Orange Scientific (производство Бельгии), Corning (производство США) площадью 25 и 75 кв. см. Тестирование производили в культуральных чашках Петри Sarstedt диаметром 3 см (рис. 3).
Опыты осуществлялись методом прямого контакта и были проведены в двух вариантах:
1. Фибробласты пересевали из культурального флакона на чашки Петри и культивировали в течение 24 часов; в течение этого времени формировался монослой клеток, на который помещали образец исследуемого материала.
2. В культуральные чашки высевали фибробласты и одновременно помещали исследуемый материал. При посеве доза постоянно (во всех случаях) составляла 20 тысяч клеток/смІ (2*104).
Контролем и в том, и в другом случае служили:
1. Чашки Петри с полной ростовой средой и образцами исследуемого материала, в которые не высевали фибробласты.
2. Чашки Петри с культурой фибробластов, которые пассировали и наблюдали одновременно с экспериментальными, но не подвергали никакому воздействию.
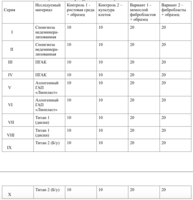
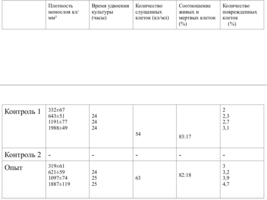
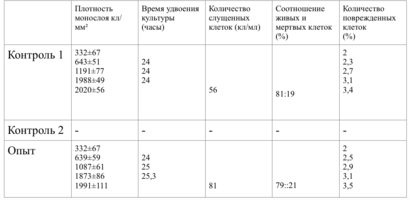
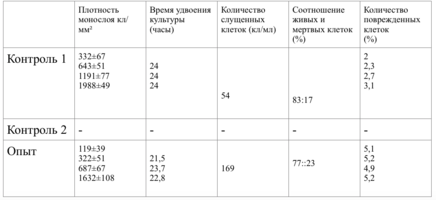
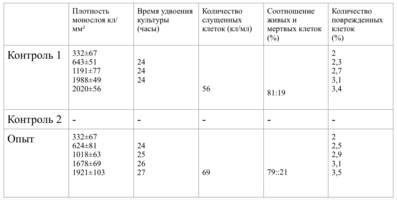
Клетки в присутствии исследуемого материала культивировали 4 суток. Схема проведения экспериментов представлена в табл. 1.
Ежедневно проводили визуальные наблюдения и морфометрию нативной культуры.
Визуально оценивали целостность монослоя, наличие слущенных клеток в культуральной жидкости, форму и размеры клеток, структуру клеток (состояние цитолеммы, состояние цитоплазмы – наличие вакуолей, зернистости, наличие и состояние отростков, структуру ядра и ядрышек, положение ядра в клетке, количество ядер и ядрышек в клетках).
Плотность клеток монослоя на единицу площади и количество поврежденных клеток (на 200 клеток) определяли с помощью окулярной сетки Автандилова, а количество слущенных клеток в культуральной жидкости и соотношение живых и мертвых клеток (при пересеве) – с помощью камеры Горяева.
На основании данных о плотности монослоя рассчитывали время удвоения культуры.
При пересеве забирали из экспериментальных и контрольных флаконов культуральную среду, в которой исследовали содержание общего белка микробиуретовым методом, свободного и белковосвязанного оксипролина (Крель А.А., Фурцева, 1968), фибронектина.
По окончании эксперимента ростовую среду из чашек удаляли, клетки фиксировали 96% спиртом и окрашивали азур-эозином по Романовскому.
РЕЗУЛЬТАТЫ ТЕСТИРОВАНИЯ РАЗЛИЧНЫХ ИМПЛАНТАЦИОННЫХ МАТЕРИАЛОВ НА КЛЕТОЧНЫХ КУЛЬТУРАХ
ГЛАВА III.
РЕЗУЛЬТАТЫ ТЕСТИРОВАНИЯ РАЗЛИЧНЫХ ИМПЛАНТАЦИОННЫХ МАТЕРИАЛОВ НА КЛЕТОЧНЫХ КУЛЬТУРАХ.
Основной целью экспериментального исследования являлось изучение реакции культуры фибробластов на различные виды гидроксиапатита, а также на металлические фрагменты имплантатов (новые и бывшие в употреблении).
Объектами исследования стали образцы синтетического гидроксиапатита (пористой гидроксиапатитной керамики производства предприятия «Фихимед», г. Ставрополь), образцы кристаллического материала минерального компонента костной ткани - так называемый «аллогенный гидроксиапатит» и недеминерализованную спонгиозу (серии «Лиопласт»).
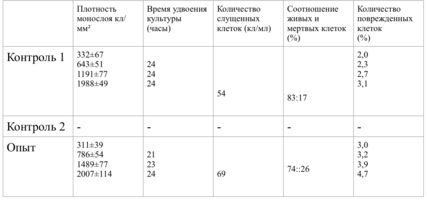
В зависимости от плотности монослоя фибробластов и их концентрации, исследование разделено на 10 серий эксперимента.
1 серия экспериментов.
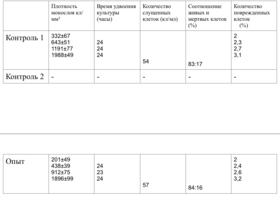
Образец исследуемого материала - кусочек недеминерализованной спонгиозы серии «Лиопласт»® объемом 125 куб. мм (рис. 31) помещали на равномерный монослой фибробластов плотностью 332 клетки/ммІ.
Этот материал имеет нейтральную реакцию (рН=7,2). Так как рН ростовой среды также 7,2-7,3, внесение образца не изменяет реакцию.
Рис. 31. Недеминерализованная спонгиоза серии «Лиопласт»®.
Через сутки монослой как в контроле, так и в опыте был целостным и равномерным, фибробласты сохраняли обычную форму и размеры.
Клеточная и ядерная оболочки четко контурировали.
Цитоплазма представлялась гомогенной.
Большинство клеток имели одно центрально расположенное ядро правильной округлой формы с 1 или 2 ядрышками.
Количество поврежденных клеток - 3%.
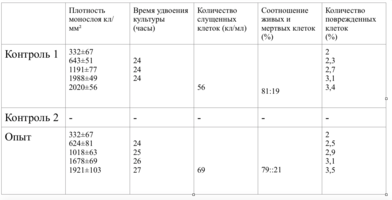
Плотность монослоя в опыте составляла 774 клетки/ммІ, в контроле 643 клетки/ммІ.
Таким образом, время удвоения культуры в опыте – 22 часа, в контроле –24 часа (табл. 6).
Вид монослоя и структура клеток не отличались от обычных в течение всех четырех суток наблюдения (рис. 32).
Количество поврежденных клеток было в пределах 2-5%.
Плотность монослоя на 2-е сутки в опыте составляла 1519 клеток/ммІ, в контроле - 1191 клеток/ммІ.
На четвертые сутки эксперимента клетки в контрольной чашке достигают плотности насыщения, которая равна для данной культуры 2020 клеток/ммІ.
Культура переходит в стационарную фазу роста, так как вступает в действие контактное торможение (нетрансформированные фибробласты в культуре растут в виде монослоя).
В связи с этим в ростовой среде несколько увеличивается количество слущенных клеток.
Плотность клеток в опытной чашке на 3 и 4 сутки превышает контрольный показатель.
Клетки лежат очень плотно друг к другу, тела их становятся короче, отростки укорачиваются и уменьшаются в количестве, но цитоплазма остается гомогенной, цитолемма и нуклеолемма четко контурируют.
В ядрах большинства фибробластов присутствует одно ядрышко.
Количество поврежденных клеток остается небольшим.
Это свидетельствует об умеренной стимуляции пролиферации фибробластов в культуре под влиянием недеминерализованной спонгиозы (таб. 9.).
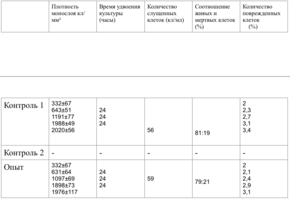
2 серия экспериментов. В культуральные чашки помещали образец исследуемого материала (кусочек недеминерализованной спонгиозы серии «Лиопласт»® объемом 125 куб. см), после чего высевали фибробласты в концентрации 20000 клеток/см².
Наблюдение через сутки показало, что фибробласты хорошо пристают к дну культуральной чашки, образуют равномерный монослой с плотностью 311 клеток/мм².
Фибробласты были распластаны по дну чашки, имели обычную для этих клеток удлиненную форму, 2-4 отростка, клеточная и ядерная оболочки четко контурировали.
Цитоплазма представлялась гомогенной (рис. 33). Большинство клеток имели одно центрально расположенное ядро правильной округлой формы с 1 или 2 ядрышками.
Количество поврежденных клеток - 3.
4 серия экспериментов. На дно культуральных чашек помещали образец исследуемого материала (ПГАК – пористая гидроксиапатитная керамика производства «Фихимед», г. Ставрополь – массой 2 мг), затем высевали фибробласты в концентрации 20000 клеток/смІ.
Наблюдение через сутки показало, что адгезивные свойства фибробластов в культуре мало изменяются под действием этого материала.
Клетки хорошо пристают к дну культуральной чашки, образуют равномерный неплотный монослой с характерным для фибробластов направлением роста; морфология их не отличается от клеток в контрольных чашках.
Вблизи глыбок исследуемого вещества направление роста и плотности монослоя клеток не изменялись (табл. 12).
5 серия экспериментов.
Образец исследуемого материала (аллогенный ГАП серии «Лиопласт»® массой 2 мг) помещали на равномерный монослой фибробластов плотностью 332 клетки/ммІ.
Этот материал имеет щелочную реакцию (рН от 8 и выше).
Через сутки вокруг образца образуется зона гибели клеток шириной 2,1±0,14 мм.
Граница этой зоны довольно резкая.
За зоной отсутствия клеток монослой до края чашки практически не отличается от монослоя в контрольных чашках.
Скорость и характер его роста незначительно отличаются от контрольных (табл. 13).
6 серия экспериментов. Образец исследуемого материала (аллогенный ГАП серии «Лиопласт»® массой 2 мг) помещали на дно культуральной чашки, после чего высевали фибробласты в стандартной концентрации.
Щелочной материал резко ухудшает прикрепление фибробластов к дну культуральных чашек (рис. 35) на всей его площади, вместе с тем прикрепившиеся клетки имеют четкие границы, нуклеолемма четко контурирует, цитоплазма гомогенная, без патологической зерностости, вакуолей и включений.
Рис. 35. Выраженная пролиферация, восстановление плотности монослоя.
Фибробласты лишь более распластаны по дну чашки, но это характерно для культуры с малой плотностью.
Вокруг образца через сутки от начала эксперимента клетки не прикрепляются (расстояние от края образца до границы 1,3±0,12 мм).
В последующие дни и до конца наблюдения плотность монослоя в отдаленной от образца зоне нарастает даже несколько быстрее, чем в контроле, клетки сохраняют обычную для фибробластов в культуре морфологию.
Большое количество слущенных клеток в ростовой среде объясняется ухудшением прикрепления пассированных клеток, а не гибелью уже прикрепившихся (табл. 14).
7 серия экспериментов. Образец исследуемого материала (фрагмент стержня из титана - диск диаметром 3 мм, толщиной 2 мм и массой 65 мг) помещали на равномерный монослой фибробластов плотностью 332 клетки/ммІ.
При световой микроскопии все поверхности диска выглядели гладкими и блестящими.
Через сутки обращало на себя внимание нарастание плотности монослоя в непосредственной близости от образца.
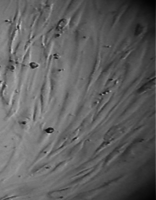
Более того, в ходе эксперимента фибробласты прилипали к ребру образца и поднимались по нему вверх, образуя по всему периметру диска утолщение в виде валика (рис 36).
Сцепление клеток с металлом было столь прочным, что уже на 3 сутки опыта образец оставался неподвижным на дне культуральной чашки при любом изменении ее положения (вплоть до того, что чашку можно было перевернуть вверх дном и держать так неограниченное время – рис. 37).
На всей остальной поверхности дна опытной чашки монослой был целостным и равномерным, фибробласты сохраняли обычную структуру, форму и размеры.
Вид монослоя и структура клеток не отличались от обычных в течение всех четырех суток наблюдения.
Количество поврежденных клеток было в пределах 2-5%.
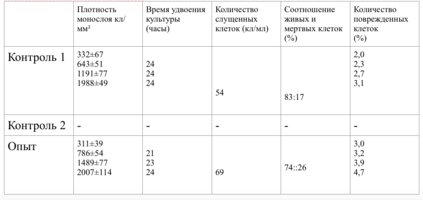
Плотность монослоя и время удвоения культуры в контроле и опыте отличались незначительно (табл. 15).
8 серия экспериментов. На дно культуральных чашек помещали образец исследуемого материала (фрагмент стержня из титана - диск диаметром 3 мм, толщиной 2 мм и массой 65 мг), после чего высевали фибробласты в концентрации 20000 клеток/смІ.
Наблюдение через сутки показало, что фибробласты пристают к дну культуральной чашки преимущественно вблизи образцов, при этом тела клеток располагаются вдоль периметра исследуемых дисков (рис. 38).
В отдаленных зонах фибробласты образуют редкий равномерный монослой, плотность которого в последующие сроки увеличивается с обычной для данной культуры скоростью, поэтому к концу наблюдения плотность насыщения не достигается.
Со вторых суток вблизи образцов фибробласты образуют второй слой клеток, а на четвертые сутки мы видим вокруг них такой же «валик», который мы наблюдали в 5 серии экспериментов (табл. 16).
9 серия экспериментов. Образцы исследуемого материала (фрагменты имплантата неправильной формы из титанового сплава в виде пластинок размерами 2,8х2,8 мм, толщиной 2 мм и массой ~ 65 мг) помещали на равномерный монослой фибробластов плотностью 332 клетки/ммІ.
При световой микроскопии вся поверхность пластинок выглядела шероховатой, на некоторых участках были выраженные выступы и впадины неправильной формы.
Так как материал поступил на исследование не только нестерильным, но после использования в качестве имплантата, он был обработан согласно правилам обработки хирургического инструментария, то есть замочен на сутки в растворе хлорамина, а затем тщательно вымыт, высушен и простерилизован в сухожаровом шкафу при температуре 200Сº в течение 3 часов.
Не смотря на это во всех чашках, содержавших образцы исследуемого материала (как в опытных с культурой фибробластов, так и в контрольных), уже через 24 часа мы наблюдали резкое помутнение ростовой среды, изменение ее рН в кислую сторону (до 4,5-4,8) и образование большого количества газа.
Это свидетельствовало о значительном бактериальном загрязнении образцов, которое не ликвидировали общепринятые обработка и стерилизация.
В связи с этим мы вынуждены были подвергнуть образцы трехкратному циклу обработки с последующей стерилизацией.
В этом случае образцы, находившиеся в термостате в полной ростовой среде, уже не вызывали роста бактериальной флоры.
При наблюдении через 24 часа особых отклонений от контрольной культуры фибробластов мы не обнаружили.
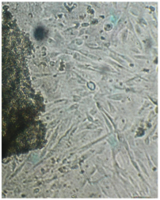
Монослой оставался целостностным и равномерным на всей поверхности чашки Петри, клетки вблизи образца сохраняли характерное для культуры фибробластов взаимное расположение и направление роста (рис. 39).
Морфология их также соответствовала сроку роста: клетки веретеновидной формы с гомогенной цитоплазмой и центрально расположенным пузырьковидным ядром неплотно прилежали друг к другу и анастомозировали своими отростками.
В последующие сроки мы также не наблюдали каких-либо морфологических признаков воздействия имплантата на культуру фибробластов.
Клетки формировали равномерный монослой, плотность которого соответствовала сроку роста культуры после пассирования и не зависела от расстояния до образца (таб. 17).
10 серия экспериментов.
Образцы исследуемого материала (фрагменты имплантата неправильной формы из титанового сплава в виде пластинок размерами 2,8х2,8 мм, толщиной 2 мм и массой ~ 65 мг) помещали на дно культуральных чашек, после чего высевали фибробласты в стандартной концентрации.
Под влиянием изучаемого металла прикрепление клеток к дну культуральной чашки несколько ухудшается, в результате чего плотность монослоя через сутки наблюдения значительно меньше, чем в контроле (табл. 18).
В то же время клетки прикрепляются равномерно по всей площади дна чашки, не проявляя какого-либо сродства к образцу.
В течение всего срока наблюдения фибробласты сохраняют характерную морфологию, скорость и характер роста (рис. 41).
3.1.Резюме.
В 1-2 сериях экспериментов при исследовании минералсодержащей недеминерализованной костной ткани отмечалась умеренная стимуляция пролиферации фибробластов в культуре под влиянием недеминерализованной спонгиозы.
При этом отмечено усиление синтетической функции клеток, уровень связанного оксипролина в опыте в 5 раз превышал контрольные показатели, что свидетельствует об усиление выработки коллагена.
В 3-4 сериях экспериментов при исследовании синтетического гидроксиапатита (ПГАК – пористая гидроксиапатитная керамика производство «Фихимед», г. Ставрополь) было отмечено, что количество поврежденных клеток в контроле и опыте мало отличалось.
ГАП располагался на монослое в виде небольших глыбок.
Со второго дня эксперимента отмечалось некоторое замедление прироста клеток в опыте по сравнению с контролем, однако количество слущенных и поврежденных клеток незначительно отличалось от контроля.
Не регистрировалось повреждающего действия на клетки, не было стимуляции пролиферации, данные результаты позволяют назвать материал полностью биоинертным.
В 5-6 сериях экспериментов при изучении кристаллического материала минерального компонента костной ткани «аллогенного гидроксиапатита», получаемого по технологии «Лиопласт», отмечалась гибель клеток в непосредственной близости от материала.
Альтерация прилежащих к биоимплантату клеток приводила к выходу медиаторов в культуральную среду.
При этом повышалась пролиферативная активность неповрежденных прилежащих клеток и клеток отдаленной зоны.
С 3-х суток, когда рН среды во флаконе выравнивалась, начиналось быстрое зарастание дна флакона. К 4 суткам монослой полностью восстанавливался.
В тоже время не наблюдалась стимуляция секреторной функции, что приводило к торможению и даже угнетению коллагеногенеза.
При биохимическом исследовании культуральной жидкости обращает внимание повышения уровня белково-связонного оксипролина, что говорит о снижении коллагеногенеза.
Следовательно, для данного материала характерно слабо выраженное воздействие на пролиферативную функцию клеток.
В 7-8 сериях экспериментов образцами исследуемого материала послужили фрагменты титанового стержня - диски диаметром 3 мм, толщиной 2 мм.
Уже через сутки обращало на себя внимание нарастание плотности монослоя в непосредственной близости от образца.
Более того, в ходе эксперимента фибробласты прилипали к ребру образца и поднимались по нему вверх, образуя по всему периметру диска утолщение в виде валика.
Сцепление клеток с металлом было столь прочным, что уже на 3 сутки опыта образец оставался неподвижным на дне культуральной чашки при любом изменении.
На всей остальной поверхности дна опытной чашки монослой был целостным и равномерным, фибробласты сохраняли обычную структуру, форму и размеры.
Вид монослоя и структура клеток не отличались от обычных в течение всех четырех суток наблюдения.
Количество поврежденных клеток было в пределах 2-5%.
Плотность монослоя и время удвоения культуры в контроле и опыте отличались незначительно.
Эти данные свидетельствуют об отсутствии пролиферативной функции у данного материала.
Обращало внимание выраженная адгезия клеток к поверхности имплантата.
При этом культура фибробластов реагировала с текстурированной поверхностью титана по типу фиброинтеграции, а культура остеобластов по типу остеоинтеграции.
Уровень свободного и связанного оксипролина в культуральной жидкости соответствовал практически контролю, что указывало на отсутствие как повреждающей, так и синтетической функций.
В 9-10 сериях экспериментов исследовали фрагменты титановых пластиночных имплантатов, отторгнувшихся вследствие периимплантита.
При световой микроскопии вся поверхность пластинок выглядела шероховатой, на некоторых участках были выраженные выступы и впадины неправильной формы.
Не смотря на стерилизацию во всех чашках, содержавших образцы исследуемого материала (как в опытных с культурой фибробластов, так и в контрольных), уже через 24 часа мы наблюдали резкое помутнение ростовой среды, изменение ее рН в кислую сторону (до 4,5-4,8) и образование большого количества газа.
Этот факт свидетельствует о значительном бактериальном загрязнении образцов, которое не ликвидировали общепринятые обработка и стерилизация.
В связи с этим мы вынуждены были подвергнуть образцы трехкратному циклу обработки с последующей стерилизацией.
В этом случае образцы, находившиеся в термостате в полной ростовой среде, уже не вызывали роста бактериальной флоры.
При наблюдении через 24 часа особых отклонений от контрольной культуры фибробластов мы не обнаружили.
Монослой оставался целостностным и равномерным на всей поверхности чашки Петри, клетки вблизи образца сохраняли характерное для культуры фибробластов взаимное расположение и направление роста.
Морфология их также соответствовала сроку роста: клетки веретеновидной формы с гомогенной цитоплазмой и центрально расположенным пузырьковидным ядром неплотно прилежали друг к другу и анастомозировали своими отростками.
Клетки формировали равномерный монослой, плотность которого соответствовала сроку роста культуры после пассирования и не зависела от расстояния до образца.
Таким образом, как показало проведенное экспериментально-морфологическое исследование под влиянием ПГАК (производство «Фихимед») не регистрировалось повреждающего действия на клетки, не было стимуляции пролиферации, что позволяет назвать материал биоинертным.
Под влиянием аллогенного ГАП (5-6 серии эксперимента) отмечается умеренная стимуляция пролиферации фибробластов в культуре.
Недеминерализованной спонгиоза (1-2 серии эксперимента), составляющая основу препарата «Лиопласт» обладает наиболее выраженными остеоиндуктивными и остеокондуктивными свойствами, стимулирует рост, развитие и дифференцировку клеток-предшественников костной ткани.
Гранулы и блоки «Лиопласта» могут длительное время находиться в имплантационном ложе, формируя вокруг себя капсулу и демаркационную зону, и постепенно замещаясь на регулярно сформированную компактную кость.
Материал усиливает митотический процесс фибробластов и клеток остеоидного ряда, одновременно создает условия для длительного депонирования основных минерализующих ионов кальция и фосфора, необходимых для минерализации индуцированного костного матрикса и компактизации основного вещества кости.
Полученные данные позволяют расположить исследуемые материалы в зависимости от степени выраженности остеогенного потенциала в следующей последовательности.
Выраженным остеопластическим потенциалом обладает недеминерализованная спонгиоза (серии «Лиопласт»), слабо выраженным – аллогенный ГАП (серии «Лиопласт»), преимущественно биоинертный материал - ПГАК (ф. «Фихимед»).
Исходя из результатов экспериментального исследования, основными биокомпозиционными материалами для клинической части исследования были выбраны недеминерализованная спонгиоза и аллогенный ГАП (серии «Лиопласт»).
КЛИНИЧЕСКАЯ ОЦЕНКА ХИРУРГИЧЕСКИХ ЭТАПОВ ДЕНТАЛЬНОЙ ИМПЛАНТАЦИИ. РЕЗУЛЬТАТЫ КЛИНИЧЕСКИХ ИССЛЕДОВАНИЙ
ГЛАВА IV.
КЛИНИЧЕСКАЯ ОЦЕНКА ХИРУРГИЧЕСКИХ ЭТАПОВ ДЕНТАЛЬНОЙ ИМПЛАНТАЦИИ. РЕЗУЛЬТАТЫ КЛИНИЧЕСКИХ ИССЛЕДОВАНИЙ.
Для настоящей части исследования было отобрано 803 больных.
Хирургическое имплантологическое лечение проведено 742 пациентам, у которых использованы методы непосредственной и ранней отсроченной дентальной имплантации.
У 15 человек плохое гигиеническое состояние полости рта явилась противопоказанием к методу имплантации.
16 человек отказались от предложенного лечения в связи с необходимостью дополнительного хирургического лечения.
Клинически резкая и неравномерная атрофия альвеолярного отростка определялась у 8 человек, наличие узкого альвеолярного гребня у 3, зубоальвеолярное удлинение у 3 пациентов, патологическое стирание твердых тканей зубов, осложненное снижающемся прикусом у 2.
После проведенного обследования, 30 пациентам было отказано в операции по общесоматическому состоянию.
1. п
Каждый пациент осматривался врачом на вторые и на седьмые сутки после операции.
Нагноений в области оперативного вмешательства, расхождения швов ни у одного пациента не наблюдалось.
На вторые сутки отмечались такие побочные реакции, как: припухлость в виде послеоперационного отека, ограничение объема движений в височно-нижнечелюстном суставе (ВНЧС), увеличение и болезненность при пальпации регионарных лимфатических узлов.
У прооперированных пациентов на 7-10 сутки после операции изучали данные общеклинического анализа крови (лейкоциты, СОЭ).
Изучаемые показатели за верхние пределы нормы не выходили.
В послеоперационный период проводилась антибактериальная и противовоспалительная терапия.
Ввиду присоединения герпетической инфекции (на фоне перенесенного ОРВИ) 12 пациентам назначались противовирусные припараты («Неовир» в/м, «ацикловир», «гепон» - внутрь), десенсибилизирующие препараты.
В клиническом разделе проведенного исследования мы решали практические задачи, вытекающие из современного состояния ортопедической стоматологической помощи и требований, предъявляемых характером стоматологической заболеваемости, а значит и нуждаемости населения в проведении тех или иных видов ортопедического лечения.
В пакете упомянутых задач мы определили следующие:
Обоснование выбора вида и формы имплантатов в зависимости от состояния альвеолярного отростка.
Разработка методики хирургического этапа имплантации с применением элементов направленной регенерации костной ткани альвеолярного отростка.
Разработка методики непосредственной имплантации в комбинации с недеминерализованной спонгиозой (серии «Лиопласт») и пористой гидроксиапатинтой керамики.
Согласно данным научно-медицинской литературы, после потери постоянных зубов в зубочелюстной системе формируется патология в виде дефектов зубных рядов.
В результате происходит последовательное изменение конфигурации альвеолярного отростка в местах включенных и концевых дефектов зубных рядов.
Основными признаками изменения конфигурации является снижение высоты, уплощение вершины альвеолярного отростка, утончение и уплотнение слизистой оболочки по вершине альвеолярного гребня.
Данные явления оцениваются как компенсаторно-приспособительные свойства зубочелюстной системы.
Нередко, уже в молодом возрасте, развивается патологическое состояние, которое характеризуется выраженными процессами атрофии альвеолярного отростка в области включенных и концевых дефектов зубных рядов, создающих проблемы в лечебно-реабилитационных мероприятиях.
На основании клинических и рентгенологических данных мы провели анализ состояния костной составляющей альвеолярного отростка при включенных и концевых дефектах зубного ряда.
2 п
4.1. Анализ состояния челюстных костей при планировании и проведении дентальной имплантации с использованием биорезорбируемых материалов.
В соответствии с поставленными задачами осуществлен анализ степени атрофии альвеолярных отростков челюстей у 326 пациентов.
Данные больные составили основную группу клинического исследования.
Для определения различий в интенсивности атрофических процессов и выявления некоторых возрастных особенностей была сформирована контрольная группа в количестве 416 человек в возрасте 16-65 лет, у которых реакция комплекса тканевых структур при формировании дефектов зубных рядов оценивалась как нормальная.
При анализе общих характеристик основной группы с выраженным типом атрофии установлено следующее.
Чаще, с кратностью 2:1, явления выраженной атрофии было больше у мужчин (68%), чем у женщин (32%).
При анализе частоты включенных и концевых дефектов с явлениями выраженной атрофии установлено, что на нижней челюсти эти явления отмечались в два раза чаще, чем на верхней (65,31+ 2,14% и 34,69±3,44% соответственно).
По выраженности совокупных признаков наиболее интенсивная атрофия альвеолярного отростка наблюдалась при включенных дефектах зубных рядов в области резцов нижней челюсти у 36,64+3,28% обследованных лиц.
На втором месте – концевые дефекты в пределах премоляров и моляров нижней челюсти – 28,18+ 3,12%.
На третьем- в пределах премоляров и первых моляров верхней челюсти, 18,856+ 2,64%.
На четвертом – в пределах фронтальной группы зубов верхней челюсти – 16,32+ 1,84%.
Согласно полученным данным обследования в пределах изучаемых возрастных групп, частота включенных дефектов зубных рядов в пределах 1-3 зубов составила 55,68+334%, а в пределах 3-5 зубов 44,32+2,3%.
В целом же, в возрасте 16-39 на долю включенных дефектов приходится 61,97+ 2,34%, а концевых 38,03+ 2,12%.
Необходимо отметить, что при обследовании 360 пациентов выявлено 432 включенных и концевых дефектов зубных рядов, т.е. в среднем по 1,2 на пациента.
Однако возрастных особенностей распределения частоты изучаемой патологии выявлено не было.
Не было существенных различий и в частоте встречаемости сочетанной патологии зубных рядов.
Лишь в возрасте старше 30 лет обнаружена устойчивая тенденция к увеличению концевых дефектов, доля которых по отношению к включенным составляет, в среднем, 34,5%.
При проведении целевого изучения интенсивной атрофии альвеолярного отростка после потери зубов у пациентов в возрасте 16-39 лет установлено, что исследуемая патология обнаруживается у 2-8% больных.
Эти пациенты нуждаются в первую очередь в коррекции участков выраженной атрофии альвеолярных отростков.
Для изучения эффективности использования костнозамещающих материалов все пациенты были разделены на 2 группы (основную и контрольную).
В основной группе при дентальной имплантации для интенсификации регенерации костной ткани использовали пористую гидроксиапатитную керамику, недеминерализованную спонгиозу и аллогенный ГАП (серии «Лиопласт»).
В контрольной группе проводили имплантацию по стандартному протоколу.
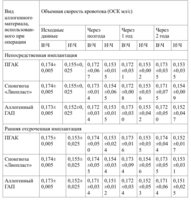
Всем пациентам проводили рентгенологическое и допплерографическое исследование через 3, 6 месяцев, 1 и 2 года.
Объем костной ткани АЧНЧ у пациентов контрольной группы ( 416 человек) был оптимальным для выполнения дентальной имплантации.
Всего в данной группе установлено 1274 дентальных имплантатов, 523 (41,1%) – на нижней челюсти и 751 (58,9) – на верхней.
По данным рентгенологического обследования высота альвеолярной части нижней челюсти колебалась от 14,0 до 19,0 мм, ширина от 8,5,0 до 11,0 мм, плотность костной ткани от 900 до 1200 единиц по шкале Хаунсфилда, что соответствует типу кости D2.
Полезная высота альвеолярного отростка верхней челюсти составила от 15 до 22 мм, ширина от 11 до 16,5 мм, плотность костной ткани по шкале Хаунсфилда 350-850 единиц, что соответствует типу кости D3.
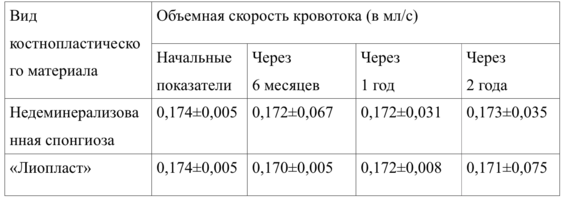
Объемная скорость кровотока костной ткани по результатам доплеровской флуорометрии составила на нижней челюсти – 0,144±0,015 мл/сек, на верхней - 0,175±0,002 мл/сек, что соответствует нормальным показателям кровоснабжения.
Всем пациентам в контрольной группе была выполнена внутрикостная дентальная имплантация.
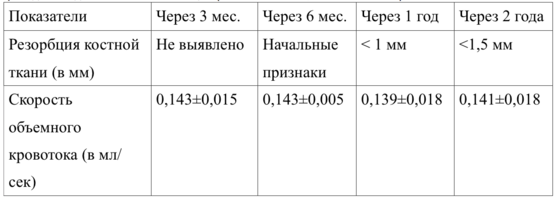
Результаты контрольного обследования через 3 месяца, 6 месяцев, 1 и 2 года приведены в таблицах 19 и 20.
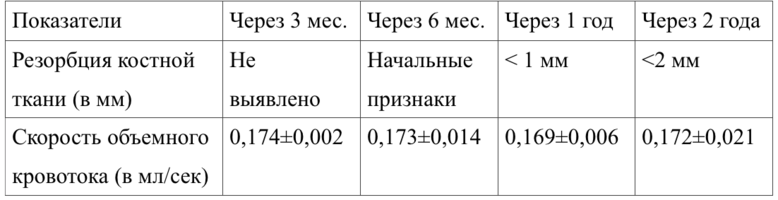
Как показали исследования, у пациентов контрольной группы после дентальной имплантации не отмечено существенных нарушений кровоснабжения, а резорбция костной ткани вокруг шейки имплантата не превысила 1-2 мм.
Отдаленные результаты (до 5 лет) таковы - удаленно 49 имплантатов из 751 установленных на верхней челюсти (6,5%) и 16 имплантатов (3,1%) из 523 установленных на нижней челюсти.
Общее число удаленных имплантатов контрольной группы составило 65 (4,9%).
Пациентам основной группы (326 человек) выполнялась непосредственная и отдаленная имплантация с использованием заменителей костной ткани.
Операция выполнена на нижней челюсти у 155 (47,4%), на верхней – у 171 (52,6%) пациентов.
Всего было установлено 768 имплантатов, 377 (49,2%) – на нижней и 391 (50,8%) – на верхней челюсти.
Плотность костной ткани до операции колебалась в пределах от 350-850 единиц (на верхней челюсти) до 850 до 1250 единиц (на нижней челюсти) по шкале Хаунсфилда.
Исходная объемная скорость кровотока составляла в среднем 0,151 ± 0,024 мл/сек (нижняя челюсть) и 0,174±0,005 мл/сек (верхняя челюсть).
По данным опроса больных в интраоперационный период боль и отечность мягких тканей оценена пациентами, как слабовыраженные (1 балл).
Нарушения чувствительности кожи нижней части лица (область подбородка, угол рта и нижняя губа) отметили 4 пациента, которым проводилась имплантация на нижней челюсти.
На снижение чувствительности в скуловой подглазничной области указал 1 пациент из тех больных, которым выполнялась имплантация на верхней челюсти.
Электровозбудимость кожи лица у данных больных составила, в среднем, 65,4±1,3 мкА в области зон иннервации нижнеальвеолярного нерва и 40,5±0,55 мкА в области зон иннервации ветвей верхнечелюстного нерва.
Состояние костной ткани альвеолярной части нижней челюсти и альвеолярного отростка верхней челюсти оценивали рентгенологически через полгода и через 1 и 2 года после операции.
Известно, что при выполнении имплантации в стандартных условиях вертикальная резорбция до шести месяцев несущественна.
Поэтому через полгода нами оценивалась только степень интеграции костной ткани с поверхностью дентальных имплантатов и объемная скорость кровоснабжения костной ткани.
Показатели объемной скорости кровоснабжения костной ткани в основной группе до и после лечения по данным рентгенологического обследования представлены в таблицах 21 и 22.
Вертикальная резорбция вновь образованной костной ткани вокруг имплантата через 1 год после проведения имплантации составила, в среднем, 1,1±0,05 мм.
Отдаленные результаты: было удаленно 17 имплантата из 377 установленных на нижней челюсти (4,5%) и 28 из 391 установленных на верхней челюсти (7,2%).
Общее количество удаленных имплантатов- 45 (5,8%).
По нашим данным, наименьшая степень вертикальной резорбции при использовании недеминерализованной спонгиозы и аллогенного ГАП наблюдалась у пациентов, которым выполняли непосредственную и отсроченную имплантацию (р<0,05).
Кроме этого, определенный интерес представляют данные об уровне кровоснабжения в области подсадки изучаемых аллопластических материалов.
Согласно полученным данным, статистически значимых различий в значениях выявлено не было (р>0,05).
Данные допплерографического исследования (объемная скорость кровотока) приведены в таблице 23 .
Таким образом, оценивая результаты проведенного допплерографического исследования до и после имплантации с использованием аллогенных материалов, статистически значимых различий нами выявлено не было.
Полученные данные согласуются с результатами исследований других авторов.
Так, Перова М.Д (1999) и А.Н. Литвиненко (2005) получили сходные результаты допплерографического исследования после непосредственной и отсроченной дентальной имплантации при хирургической реконструкции альвеолярной части нижней челюсти [34] как с использованием аутотрансплантата, так и с использованием остеорепаративных средств.
4.4. Резюме.
В процессе решения поставленных в настоящей главе задач, направленных на изучение эффективности применения пористой гидроксиапатитной керамики на этапе дентальной имплантации было установлено следующее.
Проведенные наблюдения в течении 1997-2007 гг. показали, что из 2042 установленных имплантатов в настоящее время функционирует 1934 (94,7%).
Количественный анализ клинических исследований показал, что при применении дентальных имплантатов в комбинации с недеминерализованной спонгиозой и аллогенным ГАП в процент удаленных имплантатов снижается, в среднем, на 59,5% по сравнению с контрольной группой (кровяной сгусток и ПГАК).
При рентгенологическом контроле выявлено, что в контрольной группе в 15,2% случаев наблюдается снижение высоты костной ткани челюстей на 1-2 мм через 1-2 года в области имплантатов за счет продолжающейся атрофии.
Во второй группе помимо вышеуказанных явлений, наблюдалось 4 случая периимплантита в течение 1 года после операции, при реимплантации использовали недеминерализованную спонгиозу и аллогенный ГАП (серии «Лиопласт»), в течение 5 лет наблюдений (по данным рентгенографии) отмечена положительная динамика остеорепаративного процесса.
В третьей и четвертой группе в отдаленные сроки (от года и более), было выявлено нарастание плотности костной ткани имплантационного ложа.
В данных группах отмечалось интимное прилегание новообразованной кости к имплантату, что определяло позитивную динамику остеоинтеграционного процесса.
В области имплантатов, которые были установлены с применением недеминерализованной спонгиозы и аллогенного ГАП, атрофия костной ткани через 1-2 года практически не определялась.
При использовании непосредственных имплантатов в комбинации с недеминерализованной спонгиозой и аллогенным ГАП (серии «Лиопласт») через 6 месяцев наблюдали интенсивное образование молодой костной ткани вокруг имплантатов.
Такая же картина наблюдалась при реимплантации.
При планировании непосредственной имплантации, мы учитывали, что лунка только что удаленного зуба может рассматриваться как естественное имплантационное ложе, нуждающееся в заполнении пространства между имплантатом и стенками альвеолы остеопластическим материалом, а основным показанием к операции является возможность обеспечения первичной стабильности имплантатов.
У всех пациентов, перенесших операцию непосредственной имплантации послеоперационный период протекал гладко, наблюдалась удовлетворительная интеграция имплантатов в лунке и их эффективное функционирование под зубными протезами.
Таким образом, как показали результаты наших исследований, положительный эффект при реабилитации пациентов с частичной и полной потерей зубов с помощью имплантатов, составил, в среднем, 94,7%.
Все больные удовлетворены функциональными и эстетическими результатами лечения.
Жалоб на боль, состояние дискомфорта в области имплантатов и протезов пациенты не предъявляли.
Клиническое обследование показало, что патологические изменения тканей полости рта, подвижность протезов и имплантатов у этих пациентов отсутствуют.
Кроме того, основное преимущество ранней и отсроченной дентальной имплантации в сочетании с костной пластикой биорезорбируемыми материалами заключается в возможности полноценного восстановления функционального, функционально-протетического и косметического статуса челюстно-лицевой области в кратчайшие сроки после удаления зубов.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ ИССЛЕДОВАНИЯ
ГЛАВА V.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ ИССЛЕДОВАНИЯ.
Результаты экспериментальной работы с анализом динамики репаративных процессов в альвеолярном отростке при различных путях введения синтетического и аллогенного гидроксиапата позволили установить ряд закономерных явлений, суть которых заключается в следующем.
При исследовании синтетического гидроксиапатита (ПГАК – пористая гидроксиапатитная керамика производство «Фихимед») было отмечено, что количество поврежденных клеток в контроле и опыте мало отличалось.
Уже со второго дня эксперимента отмечалось некоторое замедление прироста клеток в опыте по сравнению с контролем, однако количество слущенных и поврежденных клеток отличалось от контроля незначительно.
Не регистрировалось ни повреждающее действие материала на клетки, ни стимуляция им пролиферации, данные результаты позволяют назвать материал практически биоинертным, не оказывающим сколько-нибудь выраженного стимулирования процессов остеогенеза.
При изучении кристаллического материала минерального компонента костной ткани «аллогенного гидроксиапатита», получаемого по технологии «Лиопласт», отмечалась альтерация прилежащих к биоимплантату клеток, что приводило к выходу медиаторов в культуральную среду и повышению пролиферативной активности неповрежденных прилежащих клеток и клеток отдаленной зоны.
Не наблюдалась стимуляция секреторной функции клеток, что приводило к торможению и даже угнетению коллагеногенеза.
При биохимическом исследовании культуральной жидкости обращает внимание повышения уровня белково-связонного оксипролина, что говорит о снижении коллагеногенеза, и может характеризоваться как слабо выраженное воздействие аллогенного ГАП на пролиферативную функцию клеток.
При исследовании недеминерализованной спонгиозы (серии «Лиопласт») отмечено усиление синтетической функции клеток, уровень связанного оксипролина в опыте в 5 раз превышал контрольные показатели, что свидетельствует об усилении выработки коллагена.
Анализ изменения в клеточных популяциях соединительной ткани и кости альвеолярного отростка под воздействием недеминерализованной спонгиозы позволяет заключить, что применение данного материала ускоряет процессы пролиферации соединительнотканных клеточных структур, дифференцировку и спецификацию клеток остеогенного ряда.
Донорские свойства недеминерализованной спонгиозы обеспечивают интенсивный процесс минерализации и компактизации основного вещества кости в регенератах.
В 7-8 сериях экспериментов образцами исследуемого материала послужили фрагменты титанового стержня - диски диаметром 3 мм, толщиной 2 мм.
Полученные данные свидетельствуют об отсутствии пролиферативной функции у данного материала.
Обращало внимание выраженная адгезия клеток к поверхности имплантата.
При этом культура фибробластов реагировала с текстурированной поверхностью титана по типу фиброинтеграции, а культура остеобластов по типу остеоинтеграции.
Уровень свободного и связанного оксипролина в культуральной жидкости соответствовал практически контролю, что указывало на отсутствие как повреждающей, так и синтетической функций титановых дисков.
В заключительных сериях эксперимента исследовали фрагменты титановых пластиночных имплантатов, отторгнувшихся вследствие периимплантита.
Несмотря на проведенную стандартную обработку, выявлено значительное бактериальное загрязнение образцов, которое не ликвидировали общепринятые обработка и стерилизация.
В связи с этим мы вынуждены были подвергнуть образцы трехкратному циклу обработки с последующей стерилизацией.
При наблюдении через 24 часа особых отклонений от контрольной культуры фибробластов мы не обнаружили.
Таким образом, как показало проведенное экспериментально-морфологическое исследование под влиянием ПГАК (производство «Фихимед») не регистрировалось повреждающего действия на клетки, не было стимуляции пролиферации, что позволяет назвать материал биоинертным.
Под влиянием аллогенного ГАП (5-6 серии эксперимента) отмечается умеренная стимуляция пролиферации фибробластов в культуре. Недеминерализованной спонгиоза (1-2 серии эксперимента), составляющая основу препарата «Лиопласт» обладает наиболее выраженными остеоиндуктивными и остеокондуктивными свойствами, стимулирует рост, развитие и дифференцировку клеток-предшественников костной ткани.
Блоки «Лиопласта» могут длительное время находиться в имплантационном ложе, формируя вокруг себя капсулу и демаркационную зону, а постепенно замещаясь на регулярно сформированную компактную кость.
Материал усиливает митотический процесс фибробластов и клеток остеоидного ряда, одновременно создает условия для длительного депонирования основных минерализующих ионов кальция и фосфора, необходимых для минерализации индуцированного костного матрикса и компактизации основного вещества кости.
Полученные данные позволяют расположить исследуемые материалы в зависимости от степени выраженности остеогенного потенциала в следующей последовательности.
Выраженным остеопластическим потенциалом обладает недеминерализованная спонгиоза (серии «Лиопласт»), слабо выраженным – аллогенный ГАП (серии «Лиопласт»), преимущественно биоинертный материал - ПГАК (производство «Фихимед»).
Исходя из результатов экспериментального исследования, основными биокомпозиционными материалами для клинической части исследования были выбраны недеминерализованная спонгиоза и аллогенный ГАП (серии «Лиопласт»).
Установленное явление активной инициирующей роли недеминерализованной спонгиозы и аллогенного ГАП (серии «Лиопласт») в динамике репаративного остеогенеза определило основные принципы ремоделирования кости альвеолярного гребня, участка наиболее подверженного атрофическим процессам.
Выполненные исследования убедительно подтвердили, что на границе с ГАП, в толще кости, на 14-30 сутки определяется формирование пластины новообразованной костной ткани.
Лейкоцитарно-макрофагальный инфильтрат отсутствует.
В толще дефекта, внутри имплантатов формируются очаги новообразованной кости, соединенные инвагинатами молодой соединительной ткани.
На поверхности гранул ГАП наблюдаются митотически делящиеся фибробласты.
К третьему месяцу на поверхности блоков ГАП формируется новообразованная компактная пластина.
Таким образом, постепенно воссоздается форма ремоделированного участка альвеолярного отростка.
Полное завершение формирования гребня альвеолярной кости происходит в период между 6-12 месяцами.
Таким образом, морфологическое изучение регенеративного и остеоинтегративного процессов в альвеолярной кости при имплантации недеминерализованной спонгиозы и аллогенного ГАП в условиях эксперимента позволило обосновать возможность применения данного материала для проведения клинических испытаний при операции непосредственной и отдаленной дентальной имплантации.
Конечным эффектом процесса остеоинтеграции имплантата является образование вокруг него зрелой компактной костной ткани, полностью заместившей пространство между имплантатом и костной стенкой зубной лунки, что и прослежено в наших клинических исследованиях.
Как показало исследование, применение недеминерализованной спонгиозы и аллогенного ГАП, существенно улучшает прогноз при дентальной имплантации.
Так при применении одноэтапных имплантатов, процент неудач в основной группе был на 55,7% меньше, чем в контрольной (P<0,005).
Альвеолопластика после удаления зуба использовалась нами у 112 больных в области 237 зубов.
Контрольные обследования через 2-3 месяца определили формирование адекватной структуры костной ткани.
Сохранение размеров альвеолярного отростка челюсти составляло, в среднем, 92,7±4,11% по его ширине и 89,6±2,35% по высоте.
Использование альвеолопластики с применением остеопластических материалов позволило создать благоприятные условия для успешной дентальной имплантации.
Для контроля клинической эффективности использования биорезорбируемых материалов проводилось рентгенологическое сравнение показателей результатов пластики с соседними участками альвеолярных отростков челюстей.
Из 1354 установленных винтовых имплантатов производства компании «Конмет» было удалено 71 (5,2%) в сроки от 15 дней до 2-х месяцев после операции.
Все имплантаты были удалены до протезирования, при этом во всех случаях была проведена реимплантация с использованием недеминерализованной спонгиозы и аллогенного ГАП (серии «Лиопласт»).
Из 234 установленных винтовых имплантатов фирмы «Astra Tech», (Швеция), удалили 9 (4,3%).
Все имплантаты были установлены в боковых отделах челюстей и были удалены до протезирования в связи с подвижностью.
Из 46 установленных винтовых имплантатов фирмы «Oraltronics» (Германия) было удалено 7 (4,7%) в связи с отсутствием признаков остеоинтеграции и явлениями периимплантита.
Следует отметить, что мы не выявили существенной статичски достоверной разницы в эффективности винтовых имплантатов российского и зарубежных производителей.
Рентгенологический контроль показал снижение высоты костной ткани челюстей на 1-2 мм через 1-3 года в области имплантатов за счет продолжающейся атрофии у 13 пациентов.
Имплантаты были установлены без применения биорезорбируемых средств.
В области имплантатов, которые были установлены с применением недеминерализованной спонгиозы и аллогенного ГАП атрофия через 1-2 года практически не определялась.
При использовании непосредственных имплантатов в комбинации с недеминерализованной спонгиозой и аллогенным ГАП через 4-6 месяцев наблюдали образование костной ткани вокруг имплантатов.
Такая же картина наблюдалась при реимплантации.
Как показали данные интраоперационного наблюдения, послеоперационный период у больных протекал без осложнений.
В последующем в сроки от 4 недель до 6 месяцев после операции, проводили зубное протезирование цельнолитыми металлокерамическими конструкциями.
Как показали результаты клинических исследований, внутрилуночковая имплантация с использованием недеминерализованной спонгиозы и аллогенного гидроксиапатита (серии «Лиопласт») позволяет оптимальным образом решить проблему выбора конструкции зубного протеза для замещения дефектов в передних участках зубных рядов.
С применением этого вида имплантации отпала необходимость в использовании для закрытия дефектов мостовидных протезов, требующих препарирования зубов, порой интактных; были исключены консольные конструкции, т.к. в качестве недостающей опоры с успехом были использованы внутрилуночковые имплантаты.
Таким образом, данные экспериментального и клинического исследования убедительно свидетельствуют о высокой остеостимулирующей активности недеминерализованной спонгиозы и аллогенного гидроксиапатита (серии «Лиопласт»), использование данных материалов в клинике в качестве средства обеспечения остеогенеза при операции дентальной имплантации существенно улучшает результаты лечения.
ВЫВОДЫ
Использование недеминерализованной спонгиозы и аллогенного ГАП ускоряет процессы пролиферации соединительно-тканных клеточных элементов, инициирует и усиливает митотическую активность клеток остеогенного ряда, сокращая время синтеза костного матрикса и его созревание на 65% по сравнению с контрольной группой.
Титановые сплавы, используемый для изготовления имплантатов, не обладают повреждающей функцией для клеточных культур.
Культура фибробластов реагирует с текстурированной поверхностью титана по типу фиброинтеграции, а культура остеобластов по типу остеоинтеграции.
Бактериальное загрязнение имплантатов, удаленных вследствии периимплантита не удаляется стандартными методами санитарной обработки и стерилизации.
Выраженным остеогенным потенциалом обладает недеминерализованная спонгиоза (серии «Лиопласт»), слабо выраженным – аллогенный ГАП (серии «Лиопласт»), преимущественно биоинертный материал - ПГАК (производство «Фихимед»).
Предложенная методика обработки данных ОПТГ позволяет более точно планировать размеры имплантатов и местоположение их в костной ткани по данным ортопантомограмм пациентов, отслеживать динамику происходящих процессов в структурах зубочелюстной системы непосредственно после операции и в отдалённые сроки после имплантации.
Применение недеминерализованной спонгиозы и аллогенного ГАП на 35,5% увеличивает эффективность использования имплантатов, особенно устанавливаемых одномоментно и при реимплантации, по сравнению с контрольной группой.
При использовании дентальных имплантатов в комбинации с недеминерализованной спонгиозой и аллогенным ГАП количество удаленных имплантатов было на 54,5% меньше, чем в контрольной группе.
Отсутствует существенная статичски достоверная разница в эффективности винтовых имплантатов российского и зарубежных производителей.
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ
1. При непосредственной имплантации и реимплантации рекомендуется использовать биорезорбируемые материалы в сочетании с обогащенной тромбоцитами плазмой.
2. В дистальных отделах верхней челюсти для создания регенерата достаточной плотности в минимально короткий срок при непосредственной и ранней отсроченной имплантации рекомендуется использование недеминерализованной спонгиозы и аллогенного ГАП (серии «Лиопласт»).
3. При выборе метода имплантационного лечения при периимплантите предпочтение следует отдавать биорезорбируемым материалам с длительным сроком резорбции, позволяющим обеспечить стабильность имплантатов как в раннем, так и в отдаленном периоде.
4. Показаниями к использованию винтовых имплантатов при непосредственной и ранней отсроченной дентальной имплантации с применением остеорепаративных средств являются отсутствие воспалительно-деструктивных изменений в области удаленного зуба и возможность обеспечения оптимального контакта с костью.
5. При выборе ортопедических конструкций для протезирования на имплантатах необходимо учитывать вид и локализацию дефектов зубных рядов, а также состояние соседних зубов для равномерного распределения жевательного давления на опорные зубы.
6. Способы дезинфекции и стерилизации, применяющиеся в клинической практике, не обеспечивают стерильности удаленных при периимплантите имплантатов. Повторное использование имплантатов, ранее находящихся в организме, не допустимо.
-
Сравнительная характеристика материалов различного происхождения (ауто-, алло- и ксеногенного) для костной пластики: состав и свойства
 Обзор свойств и критериев выбора материалов в разных клинических ситуациях: аутотрансплантаты, аллоимплантаты, ксеноимплантаты, гидроксиапатит, синтетика, стеклокерамика, композиты и др.
Подробнее
Обзор свойств и критериев выбора материалов в разных клинических ситуациях: аутотрансплантаты, аллоимплантаты, ксеноимплантаты, гидроксиапатит, синтетика, стеклокерамика, композиты и др.
Подробнее
-
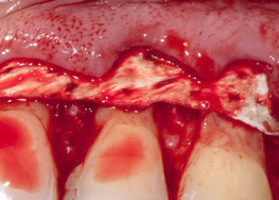
Оценка влияния остео-пластических материалов на регенерацию костной ткани после операции цистэктомии с резекцией апекса корня
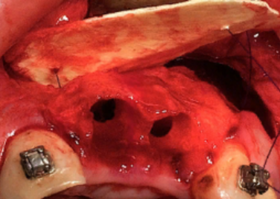 Клинико-экспериментальное исследование. Эффективность применения деминерализованной спонгиозы "Лиопласт-С"® и синтетического материала «CrossBone»® с помощью КТ
Подробнее
Клинико-экспериментальное исследование. Эффективность применения деминерализованной спонгиозы "Лиопласт-С"® и синтетического материала «CrossBone»® с помощью КТ
Подробнее
-
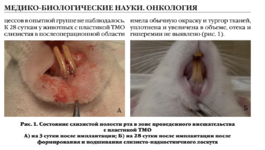
Эффективность операции коронального смещения с мембраной ТМО «Лиопласт-С»® для лечения множественных рецессий
 Файл статьи Клинико-экспериментальное исследование. Проведен анализ результатов оперативного лечения у одиннадцати пациентов устранения множественных рецессий десны 1-го и 2-го класса по Miller (1983).
Подробнее
Файл статьи Клинико-экспериментальное исследование. Проведен анализ результатов оперативного лечения у одиннадцати пациентов устранения множественных рецессий десны 1-го и 2-го класса по Miller (1983).
Подробнее
-
Optical analysis of Implants from the Dura Mater. Спек-тральный анализ Раманов-ским методом имплантатов из ТМО (dura mater)
 Файл статьи The results of the spectral analysis using the method of Raman scattering spectroscopy (RS) of dura mater (DM) samples, manufactured by technology “Lyoplast” practised in clinic in multiple gum recessions treatment.
Подробнее
Файл статьи The results of the spectral analysis using the method of Raman scattering spectroscopy (RS) of dura mater (DM) samples, manufactured by technology “Lyoplast” practised in clinic in multiple gum recessions treatment.
Подробнее