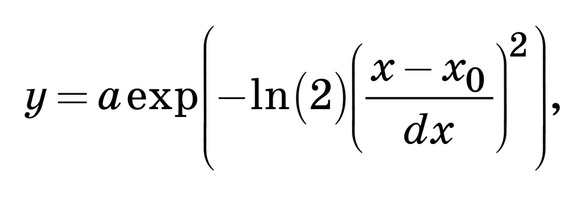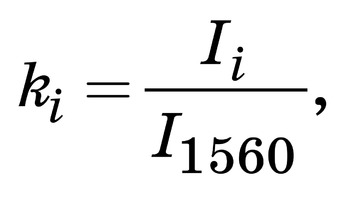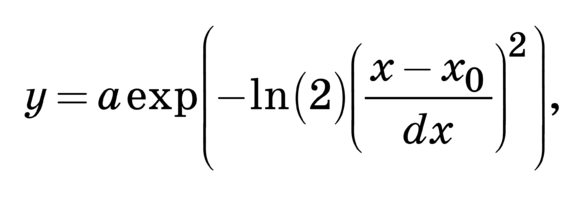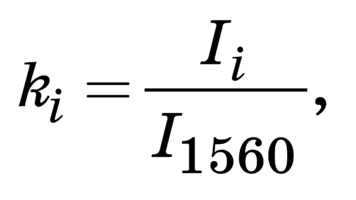+7 (929) 727 53 60 Травматология / Ортопедия
Хемометрический анализ биоимплантатов из твердой мозговой оболочки при их изготовлении
П. Е. Тимченко*, канд. физ.-мат. наук; Е. В. Тимченко*, канд. физ.-мат. наук; Л. Т. Волова**, доктор мед. наук; Н. В. Волов**, канд. мед. наук; О. О. Фролов*, студент
*Самарский национальный исследовательский университет им. академика С.П. Королёва, Самара
**Самарский государственный медицинский университет, институт экспериментальной медицины и биотехнологий, Самара
E-mail: laser-optics.timchenko@mail.ru
Поступила в редакцию 17.09.2018
DOI:10.17586/1023-5086-2019-86-01-13-20
Биоимплантаты из тканей человека на основе твердой мозговой оболочки широко используются для реконструкции и восстановления структуры опорных и соединительных тканей реципиента.
В настоящее время в мировой стоматологической практике особую актуальность приобретает лечение атрофии мягких тканей десны в области обнаженных шеек зубов — так называемых рецессий десны. Их распространенность, по данным зарубежных авторов, увеличивается с возрастом с 38% в возрастной группе 30–39 лет до 90% в возрастной группе 80–90 лет [1].
Рецессии десны бывают как единичные, так и множественные: по данным ВОЗ единичные составляют 69,3%, множественные наблюдаются в 71,4% случаев [2]. Лечение рецессий проводят с целью стабилизации некариозно-измененных зубов, снижения болевой и температурной чувствительности, улучшения внешнего вида зубного ряда [3].
За последние 30 лет были разработаны и предложены операции как без применения пластического материала, так и с ним. Тенденцией последних лет стало применение в клинической практике способа коронального смещения лоскута для устранения одиночных и множественных рецессий десны. Среди существующих технологий устранения множественных рецессий наименее травматичной является операция Zucchelli [4].
При этом золотым стандартом на сегодняшний день остается пересадка свободного соединительно-тканного лоскута, взятого с твердого неба самого больного. Однако такая операция сопровождается образованием еще одной раневой поверхности, что создает определенный дискомфорт пациенту, а ограниченный объем аутотрансплантата не позволяет проводить лечение множественных рецессий. С этих позиций применение в качестве пластического материала биоимплантатов аллогенного происхождения наиболее перспективно.
Одним из путей решения устранения рецессий является использование твердой мозговой оболочки (ТМО) человека, изготовленной по оригинальной отечественной технологии «Лиопласт»® (ТУ-9398-001-01963143-2004). Применение ТМО в данном случае является оптимальным для лечения множественных рецессий [5].
Успешный результат таких операций зависит от качества и технологии производства биоимплантатов, направленной на сохранение необходимых биологических веществ, участвующих в регенеративном процессе, таких как коллаген, гликозаминогликаны, протеогликаны [6–8], и на удаление клеточных компонентов ДНК/РНК (дезоксирибонуклеиновая кислота/рибонуклеиновая кислота) – основного фактора антигенности.
Применение ТМО также перспективно в пластической хирургии в качестве «камуфляжа» при исправлении деформаций спинки носа [9].
В процессе изготовления биоимплантатов необходим постоянный мониторинг их качества с оценкой органической составляющей. Для этого применение оптических методов весьма перспективно, так как они могут использоваться как скрининговые, быстро выполняемые, малозатратные, без разрушения представленных образцов [10, 11].
Среди физических методов широкое применение для контроля имплантатов из ТМО нашла растровая электронная микроскопия [12], рентгеновская спектроскопия [13] и спектроскопия комбинационного рассеяния (СКР) [14–16], которая имеет определенные преимущества и позволяет в реальном времени проводить неразрушающий, количественный и качественный анализ состава биологических объектов с высоким пространственным разрешением.
Так, в исследовании [17] были изучены менингиома и здоровая ТМО с помощью микроспектроскопии для оценки возможности разработки метода in vivo. В результате было установлено, что СКР позволяет дифференцировать ТМО и опухолевые ткани. Основные различия ТМО по сравнению с опухолевыми тканями проявляются в высоком содержании коллагена.
Целью настоящей работы являлась качественная и количественная оценка имплантатов из ТМО по технологии «Лиопласт»® в процессе их изготовления методом СКР.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЙ
В качестве основного метода анализа биоимплантатов был использован метод СКР, реализуемый с помощью экспериментального стенда, включающего рамановский пробник RPB-785 (фокусное рас- стояние 7,5 мм), совмещенный с лазерным модулем LuxxMaster LML-785.0RB-04 (мощность до 500 мВт, длина волны 784,7 ± 0,05 нм) и высокоразрешаю- щий цифровой спектрометр Shamrock sr-303i, обе- спечивающий спектральное разрешение 0,15 нм, со встроенной охлаждаемой камерой DV420A-OE [18] (спектральный диапазон 200–1200 нм). Спек- тры регистрировались в семи различных точках каждого образца.
Объектами исследования являлись 12 образ- цов ТМО наружной оболочки размером 10×10 мм. Все образцы были разделены на 2 группы: 1-я груп- па — образцы, обработанные ультразвуком, 2-я группа — образцы без обработки ультразвуком.
На первом этапе производства биоимплантатов из ТМО по технологии «Лиопласт»® биоматери- алы подвергались специальной ультразвуковой очистке от антигенных структур (жир, кровь, клет- ки ТМО) для проведения первичной стерилизации материала и вирусной инактивации. После этого ткани лиофилизировались, а затем на заключи- тельном этапе герметично упакованный материал стерилизовался радиационным методом. Хими- ческое воздействие при изготовлении сводилось к минимуму для снижения аллергических реак- ций и осложнений.
Обработка спектров комбинационного рассея- ния (КР) проводилась в программной среде Wolfram Mathematica 10 и заключалась в удалении шумов сглаживающим медианным фильтром по 7 точ- кам. Затем в выбранном интервале 300–2200 см–1 с помощью итерационного алгоритма [19, 20] опре- делялась аппроксимирующая линия (полином 7-й степени) автофлуоресцентной составляющей, после чего эта составляющая вычиталась для вы- деления спектра КР. Погрешность используемых коэффициентов не превышала 4% [16].
Метод моделирования спектрального контура для повышения информативности спектров был ре- ализован в программной среде MagicPlotPro 2.7.2, где проводилось разложение спектра на линии, описываемые функцией Гаусса [21]. Дальнейший хемометрический анализ с помощью метода глав- ных компонент (PCA) реализован в программной среде The Unscrambler X.
Анализ спектров комбинационного рассеяния
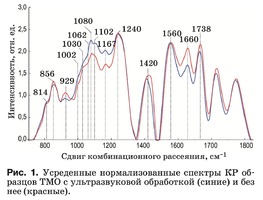
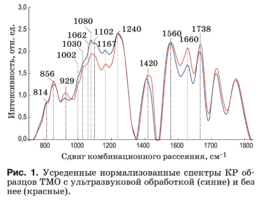
Характерные усредненные по 12 образцам спек- тры КР двух групп образцов ТМО в области 750– 2000 см–1 представлены на рис. 1. Основные раз- личия проявляются в линиях КР 929, 1002, 1030, 1080, 1102, 1167, 1660 и 1738 см–1. Анализ спек- тров КР представлен в таблице.
Интенсивность линии, соответствующей фос- фолипидам (1738 см–1), уменьшается в результате ультразвуковой обработки, что говорит о ее влия- нии на данный компонент биоматрикса.
Коллагеновая составляющая, помимо линий КР пролина и гидроксипролина, представлена груп- пами амида III (в области 1230–1280 см–1), амида II (1555–1565 см–1) и амида I (1655–1675 см–1), а так- же линиями КР 1002, 1030 и 1102 см–1, соответ- ствующими колебаниям фенилаланина.
Во всех группах образцов также присутствует линия КР 814 см–1, соответствующая фосфоди- эфирной связи ДНК/РНК, что возможно свиде- тельствует о разрушении ядер и неполном выводе из образцов остатков ДНК/РНК.
Анализ спектральных линий в области 1000–1300 см–1 затруднителен без их разделения. То есть, для получения более детальной информа- ции следует использовать математические методы обработки, позволяющие повысить информатив- ность спектров КР.
Разделение спектральных контуров
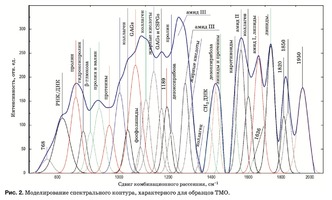
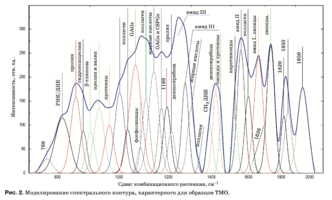
C помощью подбора спектрального контура и де- конволюции функции Гаусса в программной сре- де MagicPlotPro 2.7.2 был проведен нелинейный регрессионный анализ спектров КР, состоящий в их разложении на спектральные линии (рис. 2). В качестве пробной использовалась функция Гаусса, описываемая формулой [21]
Критериальной переменной являлась амплиту- да линий, которая зависит от независимых пере- менных (регрессоров) dx и x0, определяющих на- чальные условия анализа. Среднее значение коэф- фициента детерминации результирующего спек- тра, смоделированного с помощью пробных функ- ций исходного спектра КР в области 750–2050 см–1, составляет R2 = 0,997.
Степень обработки и качество имплантатов определяется полнотой удаления клеточных ком- понентов (ДНК, РНК) и сохранностью созданного экстраклеточного матрикса, основными компо- нентами которого являются коллаген, гликоза- миногликаны, протеогликаны [7]. Качество им- плантата напрямую зависит от содержания в нем данных компонентов.
Наибольший интерес при анализе спектров КР представляют линии 1420 и 814 см–1 (ДНК, РНК), 856 и 929 см–1 (пролин), 1062 и 1167 см–1 (GAGs, CSPGs), 1240 см–1 (амид III), 1560 см–1 (амид II), 1660 см–1 (амид I и липиды), 1080, 1440, 1738 и 1134 см–1 (липиды и жирные кислоты).
Следует отметить, что нелинейный регрессион- ный анализ спектральной кривой имеет ограни- чения, связанные с разрешением спектральных линий, поэтому достоверное разделение линий с перекрытием менее 10см-1 не представляется возможным[28].
Для контроля этих параметров и более полной относительной количественной оценки ком- понентного состава поверхности биоимплантатов на основе ТМО были введены относительные ко- эффициенты. Относительно постоянной линией в исследуемых образцах ТМО являлся амид II [7] (рис. 1) 1560 см–1, поэтому амплитуда этой разде- ленной линии использовалась в качестве знамена- теля (I1560) во введенных коэффициентах (k)
Хемометрический анализ методом главных компонент
Для анализа этих данных был выбран метод глав- ных компонент, который используется для выяв- ления скрытой структуры в больших массивах дан- ных. Он обеспечивает визуальное представление взаимосвязей между выборками и переменными и дает представление о том, как измеряемые пе- ременные выявляют сходство или различия не- которых выборок между ними. Большие матри- цы данных обычно содержат и большой объем ин- формации. Эта информация может быть частично скрыта, поскольку данные слишком сложны, что- бы их можно было легко интерпретировать.
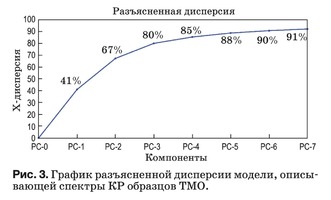
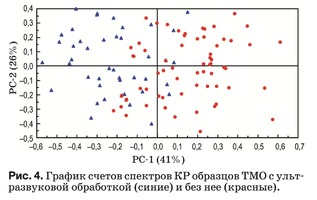
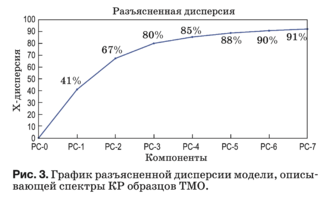
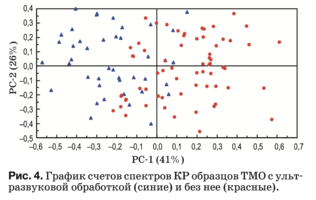
Данный метод реализован в программной среде The Unscrambler X. Используемый алгоритм для PCA описан в работе [31]. Результаты PCA пред- ставлены в виде набора данных: график счетов (рис. 3), график нагрузок (рис. 4) и разъясненная дисперсия.
Разъясненная дисперсия показывает, какая часть данных описывается моделью и выражает долю информации, описываемую созданной моде- лью, т.е. насколько хорошо модель подходит для описания этих данных. В идеале стремятся полу- чить простые модели, где остаточная дисперсия близка к нулю с минимальным количеством глав- ных компонент. Если это не так, значит, данные были сильно зашумлены или структура данных слишком сложна, чтобы учитываться небольшим количеством компонент.
В нашем случае главная компонента PC-1 не- сет в себе 41% информации, описываемой моде- лью (рис. 3), поэтому при дальнейшем анализе будет учитываться только PC-1. Компонента PC-2 в дальнейшем анализе не учитывается, поскольку, как видно из рис. 4 и 5, отсутствует информация, позволяющая интерпретировать ее физический смысл. Анализ последующих главных компонент PC-3–PC-7 также затруднителен ввиду сложной структуры данных и существования других неуч- тенных факторов, влияющих на количественный компонентный состав (шумы).
График счетов описывает структуру данных и, как правило, показывает различия или сходство между группами образцов. Рисунок 4 показыва- ет, что основные отличия между двумя группа- ми образцов описывает главная компонента PC-1. Положительные значения PC-1 в главной степени характерны для образцов без ультразвуковой об- работки и наоборот отрицательные – для образцов с ультразвуковой обработкой. Также на графике имеется область, в которой лежат счета образцов обеих групп, что говорит не только о различии, но и о сходстве по некоторым признакам (перемен- ным), в нашем случае – относительной интенсив- ности спектральных линий, соответствующих ком- понентам биоматрикса образцов ТМО.
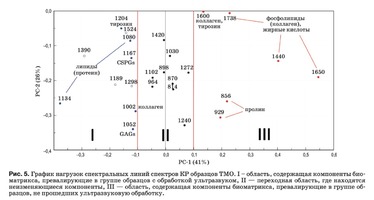
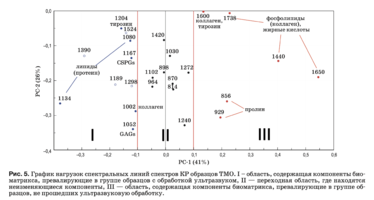
Нагрузки описывают структуру данных в виде вклада переменных в нагрузку на каждый PC и отражают, насколько хорошо PC учитывает вариацию значений переменных.
Из анализа рис. 4 и 5 и выходных данных PCA можно сделать следующие выводы:
Различия между группами образцов описыва- ют коэффициенты, отражающие относительную интенсивность линий 1660 см–1 (амид I), 1440 см–1 (липиды), 1738 см–1 (фосфолипиды), 856, 929 см–1 (пролин), 1600 см (фенилаланин). Эти переменные имеют большие значения в образцах без ультразвуковой обработки. Для образцов с ультразву- ковой обработкой характерны более высокие зна- чения переменных, лежащих в области I: 1134 см–1 (жирные кислоты), 1204 см–1 (пролин), 1080 см–1 (фосфолипиды), 1062 и 1167 см–1 (GAGs), 1002 см–1 (фенилаланин). При этом, чем выше значение PC-1 переменной, тем в большей степени она влияет на наблюдаемую разницу в компонентном составе, что, например, видно из значения коэффициента k1134. Из рис. 5 видно, что интенсивность спектральной линии 1134 см–1, соответствующей колебаниям жирных кислот и липидов, выше у образцов с ультразвуковой обработкой. Исходя из этого, поле данных на рис. 5 и было разделено на три области, где II – переходная область, содержа- щая компоненты биоматрикса, не изменяющиеся в процессе ультразвуковой обработки и характерные для обеих групп образцов. Из-за более высокой погрешности разделения спектральных ли- ний 1189, 1298, 1390 и 1524 см–1 соответствующие им коэффициенты не рассматриваются в дальнейшем анализе.
Двумерный анализ введенных коэффициентов
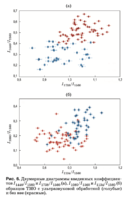
Результаты подробного анализа приведены на рис. 6, где представлены двумерные диаграммы введенных коэффициентов, на которых видны различия и сходства между образцами двух групп.
На рис. 6a представлены характерные области групп образцов и видно, что коэффициенты k1738, k1440, отражающие относительную концентрацию жирных кислот, у образцов с обработкой ультра- звуком больше, чем у группы образцов без нее, что говорит о деструктивном воздействии ультразвуко- вой обработки на жирные кислоты. Однако значе- ния коэффициентов k1134 и k1080 (рис. 6б), отража- ющих относительную концентрацию протеиновых фосфолипидов, характерных для группы образцов с обработкой, выше, чем без нее, что может быть связано с остаточной (менее 1%) концентрацией ли- пидов и жиров в связи с неполным их удалением.
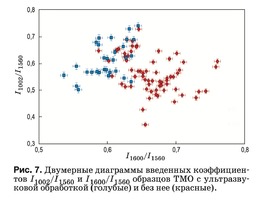
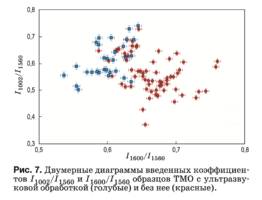
На рис. 7 представлены значения оптических коэффицентов k1002, отражающих относительную концентрацию фенилаланина в составе коллагена и протеинов, входящих в биоматрикс ТМО. С учетом данных рис. 5 можно сказать, что отличия между двумя группами по этим трем признакам мини- мальны, т.е. ультразвуковая обработка в меньшей степени влияет на концентрацию фенилаланина.
Рисунок 8 показывает, что амплитуды линий 814 и 1420 см–1, соответствующие ДНК/РНК, в про- цессе ультразвуковой обработки остаются практи- чески неизменными, что говорит о невозможности полного вывода остатков этих кислот из образцов первичной стерилизацией ультразвуком.
Значения коэффициентов, отражающих от- носительную концентрацию гликозаминогли- канов и протеогликанов, I1062/I1660 и I1167/I1660, варьируются в пределах 0,75 < I1062/I1560 < 1 и 0,5 < I1167/I1660 < 0,6 у образцов, обработанных ультразвуком, и 0,6 < I1062/I1660 < 0,9 и 0,35 < I1167/I1660 < 0,5 без ультразвуковой обработ- ки по технологии «Лиопласт»® (рис. 8б), что от- ражает рост относительной концентрации GAGs, CSPGs по отношению к коллагеновым структу- рам (амид II) при изготовлении и указывает на со- хранность компонентов, играющих важную роль в процессе приживляемости имплантата, и, следо- вательно, на получение качественного экстракле- точного матрикса.
Таким образом, при использовании анализа спектров КР математическими методами улучше- ния разрешения спектральных контуров и хемо- метрическим анализом PCA для оценки имплан- татов, изготовленных на основе ТМО, показано, что при их обработке удаляются компоненты, не- гативно влияющие на их качество, при этом со- храняется необходимый уровень экстраклеточно- го матрикса: гликозаминогликанов, коллагенов, пролинов, гидроксипролинов и фенилаланинов.
Применение низкочастотного ультразвука на этапах обработки биоимплантатов позволяет до- биться удаления липидов, что нашло подтвержде- ние в спектральной характеристике поверхностей исследуемых образцов биоимплантатов.
Проведена сравнительная спектральная оценка компонентного состава поверхностей образцов им- плантатов на основе твердой мозговой оболочки, изготовленных по технологии «Лиопласт»®, с уль- тразвуковой обработкой и без нее.
Деконволюция спектров методом подбора спек- трального контура и хемометрический анализ методом главных компонент позволяют провести расширенный компонентный качественный и ко- личественный анализ биоимплантатов на основе твердой мозговой оболочки по содержанию основ- ных показателей биоматрикса: коллагенов, про- теинов, гликозаминогликанов, протеогликанов, ДНК/РНК и установить наиболее репрезентатив- ные параметры, влияющие на качество импланта- тов при экспрессной оценке.
Установлено, что основные различия проявля- ются в линиях КР 1440, 1738, 1660 см–1 (липиды и жирные кислоты), 856 и 929 см–1 (пролин), 1062 и 1167 см–1 (GAGs, CSPGs), 1204 см–1 (тирозин).
Введены коэффициенты и проведен двумерный анализ, который показал, что при ультразвуковой обработке сохраняются основные компоненты экс- трацеллюлярного матрикса и удаляются липиды, что повышает качество материала и обеспечивает возможность хорошего клинического эффекта при лечении множественных рецессий десны и пла- стики спинки носа.
Исследования проводились при финансовой поддержке Российского фонда фундаментальных исследований, проект 17-44-630343 р_а.
- Moawia M.K., Robert E.C. The etiology and prevalence of gingival recession // J. American Dental Association. 2003. No 134. С. 220–225.
- Вольф Г.Ф., Эдит М., Ратейцхак К. Пародонтология. М.: МЕДпресс-информ, 2008. 548 с.
- Александровская И.Ю. Планирование лечебных мероприятий при заболеваниях пародонта. М.: Медицинское информационное агентство, 2010. 56 с.
- Zucchelli G., De Sanctis M.J. Treatment of multiple recession-type defects in patients with esthetic demands // J. Perio- dontol. 2000. V. 71. No 9. P. 1506–1514.
- Носова М.А. Эффективность операции коронального смещения с пластикой твердой мозговой оболочкой «Лиопласт» для устранения множественных рецессий десны // Аспирантский вестник Поволжья. 2016. No 5–6. C. 103–106.
- Носова М.А., Шаров А.Н., Волова Л.Т. Способ хирургического лечения множественных рецессий десны // Патент России No 2648855. 2018.
- Chen H., Xu P.W., Broderick N. In vivo spinal nerve sensing in MISS using Raman spectroscopy // Proc. SPIE. 2016. V. 9802. P. 98021L-1–98021L-7.
- Chen J.L., Duan L., Zhu W. Extracellular matrix production in vitro in cartilage tissue engineering // J. Transl. Med. 2014. V. 12. No 88. doi:[10.1186/1479-5876-12-98].
- Волова Л.Т., Максименко Н.А., Волов Н.В. Способ пластики спинки носа // Патент России No 2631744. 2017.
- Timchenko E.V., Tregub N.V., Taskina L.A., Selezneva E.A., Timchenko P.E. Optical methods for control of hydrogen influence on plants // Proc. SPIE. Remote Sensingand Modeling of Ecosystems for Sustainability XI. 2014. V. 9221. P. 922108.
- Zaharov V.P., Timchenko E.V., Timchenko P.E., Zolotuhina A.D., Alembekov S.V. Alteration of hydrosphere optical properties by synthetic active compounds // Computer Optics. 2011. V. 35. No 2. P. 238–242.
- Колосов В.Ю. Исследование наноматериалов методами сканирующей электронной микроскопии: методические указания. Екатеринбург: изд. Уральского государственного университета им. А.М. Горького, 2008. 17 с.
- Гоулдстейн Дж. Растровая электронная микроскопия и рентгеновский микроанализ. М.: Мир, 1984. 305 c.
- Koljenovic S., Schut T.B., Vincent A., Kros J.M., Puppels G.J. Detection of meningioma in dura mater by Raman spec-troscopy // Analyt. Chem. 2005. V. 77. No 24. P. 7958–7965.
- Anderson T.A., Kang J.W., Gubin T., Dasari R.R. Raman spectroscopy differentiates each tissue from the skin to the spinal cord: A novel method for epidural needle placement // Anesthesiology. 2016. V. 125. No 4. P. 793–804.
- Timchenko P.E., Timchenko E.V., Pisareva E.V., Vlasov M.Yu., Red’kin N.A., Frolov O.O. Spectral analysis of allogeneic hydroxyapatite powders // IOP Conf. Series: J. Phys.: Conf. Series. 2017. V. 784. P. 012060.
- Koljenovic S., Schut T.B., Vincent A. Detection of meningioma in dura mater by Raman spectroscopy // Analyt. Chem. 2005. V. 77. No 24. P. 7958–7965.
- Timchenko E.V., Timchenko P.E., Volova L.T., Pershutkina S.V., Shalkovsky P.Y. Optical analysis of aortic implants // Optical Memory and Neural Networks. 2016. V. 25. No 3. P. 192–197.
- Zhao J., Lui H., McLean D.I., Zeng H. Automated autofluorescence background subtraction algorithm for biomedical Raman spectroscopy // Appl. Spectrosc. 2007. V. 61. P. 1225–1232.
- Timchenko E.V., Timchenko P.E., Volova L.T., Dolgushkin D.A., Shalkovsky P.Y., Pershutkina S.V. Detailed spectral analysis of decellularized skin implants // J. Phys.: Conf. Series. 2016. V. 737. No 012050. P. 1–4.
- Motulsky H.J., Christopoulos A. Fitting models to biological data using linear and nonlinear regression. A practical guide to curve fitting. GraphPad Software Inc. San Diego CA., 2003. 352 p.
- Thomas G.J. Raman spectroscopy of viruses and protein-nucleic acid interactions // The SPEX Speacker Industries Inc. 1976. V. 21 No 4. P. 1–12
- Shetty G., Kedall C., Shepherd N., Stone N., Barr H. Raman spectroscopy: Evaluation of biochemical changes in carcino- genesis of oesophagus // British J. Cancer. 2006. V. 94. P. 1460–1464.
- Cristina M.M., Halmagyi A., Mircea D.P., Ioana P. FT-Raman signatures of genomic DNA from plant tissues // Spec- troscopy. 2009. V. 23. P. 59–70.
- Rudd T.R., Hussain R., Siligardi G., Yates E.A. Raman and Raman optical activity of glycosaminoglycans // Chem. Com- mun. 2010 V. 46. No 23 P. 4124–4126.
- Malini R., Venkatakrishma K., Kurien J. Discrimination of normal, inflammatory, premalignant, and malignant oral tissue: A Raman spectroscopy study // Biopolymers. 2006. V. 81. No 3. P. 179–193.
- Lakshimi R.J., Kartha V.B., Krishna C.M., Solomon J.G.R., Ullas G. Tissue Raman spectroscopy for the study of radia- tion damage: Brain irradiation of mice // Radiation Research. 2002. V. 157. P. 175–182.
- Krafft C., Neudert L., Simat T., Salzer R. Near infrared Raman spectra of human brain lipids // Spectrochimica. 2005. V. 61. P. 1529–1535.
- Ruiz-Chica A.J., Medina M.A., Sanchez-Jimenez F., Ramirez F.J. Characterization by Raman spectroscopy of conforma- tional changes on guanine-cytosine and adenine-thymine oligonucleotides induced by aminooxy analogues of spermi- dine // J. Raman Spectroscopy. 2004. V. 35. P. 93–100.
- Cheng W.-T., Liu M.-T., Liu H.-N., Lin S.-Y. Micro-Raman spectroscopy used to identify and grade human skin piloma- trixoma // Microscopy Research and Technique. 2005. V. 68. P. 75–79.
- Martens H., Naes T. Multivariate calibration. Wiley, 1991. 419 p.
-
Comparative spectral analysis of the component composition of bioimplants making in different ways for the treatment of gingival recession
 ПодробнееФайл статьи P. E. Timchenko, El. V. Timchenko, L. T. Volova, O. O. Frolov, V. D. Meseyarakov, E. I. Pugachov, "Optical estimation of the composition of bone implants during processing," Proc. SPIE 11074,
ПодробнееФайл статьи P. E. Timchenko, El. V. Timchenko, L. T. Volova, O. O. Frolov, V. D. Meseyarakov, E. I. Pugachov, "Optical estimation of the composition of bone implants during processing," Proc. SPIE 11074, -
Research of component composition of mineralized bone implants by Raman spectroscopy
 ПодробнееФайл статьи P. E. Timchenko, El. V. Timchenko, L. T. Volova, O. O. Frolov, V. D. Meseyarakov, E. I. Pugachov, "Optical estimation of the composition of bone implants during processing," Proc. SPIE 11074
ПодробнееФайл статьи P. E. Timchenko, El. V. Timchenko, L. T. Volova, O. O. Frolov, V. D. Meseyarakov, E. I. Pugachov, "Optical estimation of the composition of bone implants during processing," Proc. SPIE 11074 -
Raman spectroscopy for evaluation of dura mater based grafts
 Файл статьи P. Е Timchenko, Е. V Timchenko, L. Т Volova, О. О Frolov, А. U Kulabuhova, N. K KiykoПодробнее
Файл статьи P. Е Timchenko, Е. V Timchenko, L. Т Volova, О. О Frolov, А. U Kulabuhova, N. K KiykoПодробнее -
Analysis of the mineral component for cortical bone tissue by Raman spectroscopy after ovariectomy and its treatment with allogeneic hydroxyapatite
 Файл статьи E. Timchenko1, P. Timchenko1, E. Pisareva1, M. Vlasov2, L. Volova2, I. Fedorova1, A. Tumchenkova1, M. Gorchenkova1 and A. Subatovich1Подробнее
Файл статьи E. Timchenko1, P. Timchenko1, E. Pisareva1, M. Vlasov2, L. Volova2, I. Fedorova1, A. Tumchenkova1, M. Gorchenkova1 and A. Subatovich1Подробнее