+7 (929) 727 53 60 Травматология / Ортопедия
Сравнительная характеристика материалов различного происхождения (ауто-, алло- и ксеногенного) для костной пластики: состав и свойства
Представлена сравнительная оценка существующих материалов для костной пластики. Известные костно-пластические материалы обладают ограниченным набором свойств, преимущественно являясь остеокондуктивными матрицами. Материалы на основе деминерализованной кости сочетают остеокондуктивные и остеоиндуктивные свойства, ряду материалов присущ антибактериальный эффект за счет лекарственных средств, введенных в их состав. Данный обзор может помочь хирургам в осмысленном выборе материала, исходя из необходимых в определенной клинической ситуации свойств. Ключевые слова: костно-пластические материалы, ауто-трансплантаты, аллоимплантаты, ксеноимплантаты, гидроксиапатит, стеклокерамика, композиты.
Comparative Characteristics of Materials for Bone Grafting: Composition and Properties I.A. Kirilova, M.A. Sadovoy, V.T. Podorozhnaja Comparative characteristics of existing materials for bone plastics are presented. Known osteo-plastic materials have a limited set of properties mainly being osteoconductive matrices. Materials based on demineralized bone combine both osteoconguctive and osteoinductive properties. Some of these materials have inherent antibacterial effect due to drugs introduced into their composition. This survey can help surgeons in the implementation of intelligent selection of material with properties needed in particular clinical situation. Key Words: osteo-plastic materials, autografts, allografts, xenografts, hydroxyapatite, glass ceramics, composites. Hir. Pozvonoc. 2012;(3):72–83.
Биологические костно-пластические материалы
Разнообразие представленных на территории России материалов для костной пластики отечественно- го и зарубежного производства ста- вит перед хирургами вопрос выбора материала, оптимального для опре- деленной клинической ситуации. Существует большое количество публикаций с характеристиками отдельных материалов, но часто они подготовлены сотрудниками фирм- производителей и носят реклам- ный характер. Статьи с результата- ми морфологического сравнения костных материалов стали появ- ляться в отечественной литерату- ре только в последние 2–3 года [6, 7, 32]. При этом следует заметить, что материал для костной пластики, то есть для реконструктивно-восста- новительных операций на костной ткани в травматологии и ортопедии, челюстно-лицевой хирургии, кост- ной онкологии, может отличаться по происхождению [6, 7, 18, 40].
Существуют биологические мате- риалы (ауто- и алломатериалы, ксено- материалы, брефоматериалы, биоло- гически активные молекулы белковой и небелковой природы, обладающие свойствами факторов роста), искус- ственные (синтетические) на основе β-трикальций фосфата, гидроксиапа- тита, различных типов керамики, суль- фата кальция и др., композиционные (композиты), то есть смесь нескольких синтетических и/или биологических материалов для придания им синер- гичных свойств. Биологические материалы для вос- становления костной ткани по про- исхождению делятся на аутогенные (донором является сам пациент), алло- генные (донором является другой человек), ксеногенные (донором явля- ется животное), биологически актив- ные молекулы белковой и небелко- вой природы, обладающие свойствами факторов роста [6]. Рассмотрим более подробно состав и свойства материалов и импланта- тов, предварительно сгруппированных по происхождению.
Биологические костно-пластические материалы
Аутотрансплантаты
Аутогенная кость является лучшим трансплантатом и основным типом костных трансплантатов, широко используемых в виде маленьких фрагментов и кусочков. Прогресс в обла- сти микрохирургии позволил пере- саживать костные аутотрансплантаты на сосудистой ножке, включая сег- мент малоберцовой кости, ребра, под- вздошной или лучевой кости, часто в сочетании с сопутствующими мяг- 73 ХИРУРГИЯ ПОЗВОНОЧНИКА Экспериментальные исследования 3/2012 (С. 72–83) И.А. Кирилова и др. Сравнительная характеристика материалов для костной пластики: состав и свойства кими тканями [1–4, 6, 17, 21, 35, 36, 38, 40]. Аутотрансплантаты отличаются по строению и свойствам (табл. 1). Аутогенная губчатая кость из-за отсутствия иммуногенности обла- дает непосредственно остеогенны- ми и остеоиндуктивными свойства- ми и имеет идеальную структуру для остеокондукции, является иде- альным пластическим материалом с биологических позиций, хотя огра- ничена в объеме и в механической прочности [6, 17, 21, 35, 36, 38, 40].
Именно на аутогенную губчатую кость, как на эталон анатомо-функциональ- ных свойств, ориентируются произ- водители искусственных костезаме- щающих материалов. Кортикальная аутокость имеет высокие прочностные характеристики, но уступает губчатой по остеоиндуктивным и остеокондук- тивным свойствам, а в случае изоли- рованного использования не содержит остеопрогенираторных клеток. Однако забор васкуляризированного и неваскуляризированного аутотран- сплантатов влечет за собой дополни- тельный разрез, увеличение болез- ненности и дефицит кости в области донорского места [5, 6]. Кроме того, забор аутологичной кости связан с достаточно высо- ким уровнем осложнений – от 8,6 до 20,6 % [5]. Проблематично исполь- зование аутокости в случаях массив- ной потери фрагментов кости. Выбор донорских мест и количество кости, которое может быть забрано, ограничены [5, 6].
Попытка обойти это ограниче- ние приводит к использованию алло- или ксенокости и к изучению альтер- нативных пересадок [17, 21, 35, 36, 38]. Аллоимплантаты Костные аллоимплантаты все чаще используются из-за своей доступности [1–4, 6, 17, 19, 21–23, 25, 27, 35, 36, 38, 40]. Их применяют в виде малых фрагментов, целых подпорок, сег- ментарных, костно-хрящевых транс- плантатов и композиционных мате- риалов на их основе, которые могут быть получены от живых или умер- ших доноров. От живых доноров могут быть забраны головки бедра во время артропластики тазобедренного сустава, которые в последующем могут использоваться как аутоимплан- таты у пациента при ревизионном вмешательстве или при приготовлении аллоимплантатов для ревизион- ного эндопротезирования [34, 42, 45]. От умерших доноров обычно заби- рают большие сегменты кости или целые костно-хрящевые комплексы для последующего изготовления раз- личных типов аллоимплантатов. Большинство исследователей, занимающихся костной аллопла- стикой, придерживаются мнения, что регенерация костной ткани и замещение имплантата осущест- вляются за счет костного ложа реци- пиента и метаплазии соединительной ткани, окружающей пересаженную аллогенную кость и плотно приле- гающей к ней по ходу врастающих в ложе сосудов.
Синхронная перестройка костных аллоимплантатов осуществляется при одинаковом уча- стии как костного ложа реципиента, так и окружающих тканей и враста- ющих сосудов [21, 25, 35, 36, 38, 40]. Следует отметить, что репаративный остеогенез – многокомпонентный процесс, основными составляющи- ми которого являются дифференци- рование клеток, их пролиферация, резорбция погибшей кости и ново- образуемой кости при ее ремодели- ровании, формирование органиче- ского внеклеточного матрикса, его минерализация. Все эти процессы реализуются одновременно, но на разных этапах репаративного остео- генеза один из них может быть пре- обладающим [21]. После пересадки консервирован- ные аллогенные аллоимплантаты подвергаются перестройке по тем же законам, что и при аутопластике, одна- ко скорость этих процессов ниже [21, 35, 36, 38, 40].
В зависимости от способа пред- варительной химической обработки костной ткани аллоимплантаты быва- ют трех видов [18]: – нативный, с сохраненной кост- ной структурой и соотношением органического и минерального компонентов; – деминерализованный, лишенный минерального компонента органи- ческий матрикс кости; – депротеинизированный, лишенный органического компонента мине- ральный компонент или кристаллическая решетка гидроксиапатита, биологического происхождения. Кроме химической обработки, фрагменты аллокости отличаются по размерам и форме, которые при даются материалу в ходе моделирова- ния. В зависимости от способа пред- варительной химической обработки костной ткани и способов стерилиза- ции и консервации изменяются физи- ко-химические, остеокондуктивные и остеоиндуктивные свойства костных аллоимплантатов [18].
Так, фрагменты нативной кости сохраняют не только состав и соотно- шение минерального и органического компонентов, но и свои прочностные характеристики, характерные для ана- логичных сегментов скелета. Фрагменты депротеинизирован- ной аллокости обладают меньшей иммуногенностью, по сравнению с нативными костными фрагмента- ми, поскольку в процессе обработ- ки лишаются органического компо- нента кости. Кроме того, процесс депротеинизации повышает вирус- ную и бактериальную безопасность аллокости, на которую постоянно ссылаются производители синтетических костезамещающих материа- лов. По сути полученный подобным образом костный материал представ- ляет собой карбонатгидроксиапатит аллогенного происхождения с сохра- ненной архитектоникой и микроэле- ментным составом [18]. Деминерализованные костные аллоимплантаты за счет освобож- дения от минерального компонента не обладают прочностными свойства- ми [24, 30, 31]. Целая группа факторов роста, содержащихся в деминерали- зованной костной ткани, стимулиру- ет как пролиферацию и дифферен- цировку родоначальников остеодифферона, так и ангиогенез [17, 30, 31, 35, 36, 38, 40]. Уникальные свойства деминерализованной кости позволяют создавать на ее основе костно-пласти- ческие материалы с остеоиндуктивны- ми свойствами (табл. 2). Брефотрансплантаты (костная ткань плода и мертворожденных детей) используются при замещении костного дефекта и стимуляции репа- ративной остеорегенерации [22, 29]. Однако использование брефотканей по этическим соображениям запреще- но во многих странах мира, предпо- лагается введение подобного запрета и в Российской Федерации [28]. Материалы с различными свойства- ми и характеристиками можно использовать только в тех условиях, в которых эти характеристики являются самыми востребованными (табл. 3). Наиболее частой причиной исполь- зования костно-пластических матери- алов являются опухоли и опухолепо- добные заболевания [1–4, 8, 19, 23, 26, 30, 31].
Однако и при лечении, каза- лось бы, одной нозологии виды и спо- собы использования костных материа- лов различны. И связано это не только с величиной очага поражения, но и с расположением в сегментах скелета и биомеханической нагрузкой, кото- рую испытывает тот или иной сегмент опорно-двигательного аппарата. Пересадка тканей может стать одним из инструментов регенера- тивной хирургии как биологический метод стимуляции репаративной реге- нерации [25]. Однако пересадка тканей традиционно рассматривается хирургами, прежде всего, как способ замещения дефектов, образующихся вследствие иссечения патологически измененных тканей. Поэтому различные аспекты трансплантации тканей разрабатываются в основном спе- циалистами в области пластической и реконструктивной хирургии.
Проблемы этического и юридиче- ского характера в некоторых странах при получении и обработке алло- имплантатов от человека, а также широкая доступность тканей живот- ных стимулировали использование ксенокости как альтернативы ауто- и аллокости, поскольку потребность в костно-пластическом материале стремительно увеличивается. Первым исследованиям препятствовала высо- кая иммуногенность тканей животных [30, 31]. Однако новые шаги в обработ- ке ксенокости, например частичная депротеинизация, выделение состав- ляющих со сниженной антигенно- стью и механическими свойствами подобными человеческой кости, расширили возможности ее использо- вания. Иммуногенность ксенокости может быть снижена разнообраз- ными процедурами приготовления, включая замораживание, лиофили- зацию, гамма-излучение и обработку химическими средствами [30, 31]. Полученные трансплантаты, хотя низкоиммуногенны, имеют мини- мальный остеогенный потенциал или совсем его не имеют.
Они действуют в основном как микропористый остов или каркас, на осно- ве которого хорошо формируется новая кость (остеокондукция) путем аппозиционного роста. Ксеногенные имплантаты пред- ставляют собой ткани, взятые от раз- личных животных. Для клинической практики интерес представляют два источника – природный коралл и бычья кость [7, 12, 16, 37, 39, 41]. Преимущественно на их основе изго- тавливают различные ксеноимплан- таты для клинического использова- ния как в травматологии и ортопедии, так и в стоматологии и костной онко- логии (табл. 4). Природный коралл является остео- кондуктивным и не передает заболеваний реципиентам. Трансплантаты из бычьей кости получают из натуральной кости путем удаления из нее органических веществ. Основным пре- имуществом этого материала, по срав- нению с подобными синтетическими тканями, является структура, схожая с человеческой костью. Неоргани- ческая бычья кость – это скелетный гидроксиапатит, содержащий микро- и макропоры кортикальной и губча- той костей, остающийся после хими- ческого или термического удаления органических веществ. Наличие есте- ственной пористой структуры очень важно для прорастания новой костной ткани [30, 31, 33, 35, 36, 38, 40].
Синтетические костно-пластические материалы
Использование для пластики дефектов кости искусственных материалов, идентичных минеральному компо- ненту костного вещества, привлекает пристальное внимание исследовате- лей. Особое место среди биоактивных керамик занимают трикальцийфос- фат и гидроксиапатит, обладающие не только высоким сродством с костной тканью, но и способностью к биодеградации [1, 8, 11, 13–15, 20, 30, 31, 33, 35, 38, 46].
Препараты синтетического гидрок- сиапатита для медицинского примене- ния известны с конца 60-х гг., а иссле- дования в области технологии и синтеза не прекращаются до настоящего времени. Гидроксиапатит – полный химический и кристаллохимический аналог минерального вещества кости мле- копитающих, что обусловливает его уникальные биологические свойства: абсолютную иммунную совместимость и биоактивность – способность стимулировать остеогенез, сращиваться с костью, служить строительным мате- риалом для синтеза кости и входить в состав костной ткани, замещающей имплантат из гидроксиапатита [8, 11, 14, 15, 33].
Гидроксиапатит – биологически совместимое минеральное вещество, усредненный состав его обычно изо- бражается как Ca10(PO4)6(OH)2. Свойства гидроксиапатита, как заменителя кости, позволяют создавать на его основе костезамещающие мате- риалы (табл. 5). Материалы на основе гидроксиапатита широко используются в клиниче- ской практике для замещения костных дефектов [1–4, 6, 10, 13, 15, 20, 27, 35, 38, 44].
К современным материалам последне- го поколения следует отнести биоак- тивные стеклокристаллические материалы, состоящие из стекловидной матрицы и микрокристаллов размером около 4 мкм, разработка которых велась биоматериаловедами. Результатом российской научно-технической программы «Био- ситалл» явились разработка и промышленный выпуск отечественных биоситаллов. Например, микрогранулированный пористый стоматологический рентгеноконтрастный материал «Биосит-СР» на основе био- ситалла М-31, который разработан в Санкт-Петербургском государственном технологическом университете, отличается тем, что в качестве кристаллической фазы, которая состав- ляет до 3 % объема, содержит аналог биоминерала кости даллит (карбок- сигидроксиапатитата). Он создан в системе оксидов кремния, фосфора, алюминия, кальция, магния, цинка.
Препарат «Биосит-СР» применяют для заполнения костных полостей во время операций от 2/3 до полно- го костного дефекта, для заполнения костных карманов при пародонти- те, для устранения костных дефектов после удаления дентальных имплантатов, а также при периимплантитах и альвеолитах [9]. Биостекла и стеклокерамика (биоситаллы) при имплантации в костный дефект не капсулируются, а находятся в прямом контакте с костной тканью. Основным условием для связывания стеклокерамики с костной тканью является образование апатитового слоя на их поверхности в биологической среде.
Апатитовый слой формируется в результате химической реакции стекол и стеклокерамики с окружающей биологической жидкостью, в которой выделяются ионы кальция и образуется гидратированный слой SiO2. Использование синтетических материалов может привести к осложнениям, при которых возникает необходимость удаления не только материала, но и части кости, а также окружающих тканей. Это связано с технологией получения материала (высокие температуры, спекание, высокое давление). Все эти факторы, увеличивая прочностные характеристики материала, нарушают одно из основных условий – способность к биодеградации в организме чело- века с последующим замещением органотипической костной тканью [9, 43, 47]. Для использования в качестве заменителя кости выпускают несколько видов биостекол (табл. 6)
Композиционные костно-пластические материалы
Композиционные костно-пластические материалы или композиты – это смесь (композиция) нескольких синтетических и/или биологических материалов для придания им синер- гичных свойств. Применяются разновидности ком- позиционных материалов в виде гра- нул, лент, блоков, состоящих, например, из смеси гидроксиапатита (от 30 до 50 %) и связующих биополимеров, в основном коллагена [6, 7, 15, 20, 33].
Примеры различных композици- онных материалов, используемых в клинической практике, приведены в табл. 7. В качестве основных компонентов используются различные субстраты и/или их комбинации. Основное достоинство таких мате- риалов в удобстве работы с ними – возможности подгонки размеров непосредственно в операционной, пластичности при заполнении дефектов кости и т. д.
При этом коллаген частично используется организмом как строительный материал орга- нического компонента кости. Недостатки композиционных препаратов связаны с тем, что количество орга- нического компонента, выбираемое исходя из условий получения удоб- ных физико-химических свойств, обычно намного больше, чем нужно для синтеза кости, а качество колла- гена не соответствует оптимальному, с точки зрения иммунных реакций организма.
Широкий ассортимент материалов для костной пластики свидетельствует о том, что необходима разработка материалов, позволяющих формироваться регенерату органотипического строения на их основе. Костно-пласти- ческий материал должен при имплантации в костное ложе компактного строения приводить к формированию кости остеонного строения, а при имплантации в губчатую кость – трабекулярного.
Таким образом, материал должен обладать следующим набором характеристик: – идентичность химического соста- ва и архитектоники свойствам кости (зоне предполагаемой имплантации); – резорбируемость, продленная во времени от 3 до 12 мес.; – замещение органотипической костной тканью; – моделируемость; – остеокондуктивность; – остеоиндуктивность; – адресная доставка и пролонгиро- ванное действие лекарственных средств в зоне дефекта (антибак- териальный или анальгетический эффект). Анализ существующих компо- зиционных костно-пластических материалов на основе наполнителей биологического и синтетиче- ского происхождения позволил выя- вить закономерности свойств материалов в зависимости от их состава.
Материалы моносостава могут пред- ставлять собой фрагменты различной формы (монолитные или пористые) или крошку (от крупной до мелкодисперсной). Композиционные материалы в дополнение к вышеперечисленным формам могут быть представлены гелевой формой в виде пасты или замазки, могут затвердевать и сохранять форму. Ни один из вышеперечисленных материалов не обладает остеогенны- ми свойствами, поскольку не содержит клеточных элементов. Биологические материалы, изготов- ленные из алло- или ксенокости, облада- ют следующим набором характеристик: – остеокондуктивность; – резорбируемость остеокластами в сроки от 4 до 12 мес.; – замещаемость органотипической костной тканью (для аллогенных материалов) и формирование гру- боволокнистой соединительной ткани (для ксеногенных материалов) [3]; – остеоиндуктивность для материалов на основе органического матрикса аллокости – деминерали- зованного костного трансплантата. Для синтетических материалов основной характеристикой является остеокондуктивность.
Монолитным образцам свойственна стабильность химического состава и геометрической формы; кроме того, они способствуют образованию вокруг себя соединительно-тканной капсулы – инкапсулируются. Пористые образцы имеют неконтролируемые сроки рассасывания (путем гидролиза от 5–6 недель до 3 лет), причем рассасывание мате- риала часто не сопровождается формированием кости. К сожалению, даже сегодня все попытки приготовить искусственный костный материал, пригодный для клинического использования и обладающий хорошей физиологической приживаемостью, биосовместимостью и стабильностью на про- тяжении длительного времени, имеют лишь относительный успех. Это наглядно демонстрирует превосходство и сложность созданных природой структур [4, 8, 14].
1. Актуальные вопросы имплантологии в травмато- логии и ортопедии: М-лы междунар. науч.-практ. конф. Гродно, 2000.
2. Актуальные вопросы тканевой и клеточной транс- плантологии: М-лы III Всерос. симп. с междунар. участием. М., 2007.
3. Актуальные вопросы тканевой и клеточной транс- плантологии: М-лы V Всерос. симп. с междунар. участием. Уфа, 2012.
4. Актуальные вопросы травматологии и ортопе- дии третьего тысячелетия: М-лы Межрегион. науч. конф. Омск, 2000.
5. Ардашев И.П., Григорук А.А., Плотников Г.А. и др. Возможные осложнения после взятия ауто- трансплантата из крыла подвздошной кости // Современные технологии в травматологии и ортопедии. М., 1999. С. 191–192.
6. Ардашев И.П., Подорожная В.Т., Кирило- ва И.А. и др. Передний спондилодез в экспе- рименте // Хирургия позвоночника. 2008. № 1. С. 66–73.
7. Артюшкевич А.С. Средства и хирургические способы, стимулирующие репаративные процес- сы в тканях периодонта [Электронный ресурс] // http://bone-surgery.ru/view/sredstva_i_hirurgicheskie_ sposoby_stimuliruyuschie_reparativnye_processy_v_
8. Баринов С.М., Комлев В.С. Биокерамика на основе фосфатов кальция. М., 2005.
9. Беззубик С.Д., Гречуха А.М. Эксперименталь- ное обоснование применения биоактивного сте- клокристаллического материала «Биоситалл-11» для замещения костных дефектов челюстных костей // Стоматология. 2009. № 3. С. 26–28.
10. Белозеров М.Н. Оценка остеопластических свойств различных биокомпозиционных мате- риалов для заполнения дефектов челюстей: Дис. … канд. мед. наук. М., 2004.
11. Берченко Г.Н., Кесян Г.А., Уразгильдеев Р.З. и др. Сравнительное экспериментально-мор- фологическое исследование влияния некоторых используемых в травматолого-ортопедической прак- тике кальцийфосфатных материалов на активизацию репаративного остеогенеза // Бюл. Восточно-Сибир- ского науч. центра СО РАМН. 2006. № 4. С. 327–332.
12. Биоматрикс [Электронный ресурс] // http://bioimplantat.ru/biomatrix.html
13. Григорьянц Л.А., Зуев Д.В., Бадалян В.А. и др. Хирургическое лечение околокорневых кист челю- стей с использованием гидроксиапатита ультра- высокой дисперсности без резекции верхушек корней // Клиническая стоматология. 1997. № 3. С. 54–58.
14. Дорожкин С.В. Биокерамика на основе орто- фосфатов кальция (обзор) [Электронный ресурс] // http://bone-surgery.ru/view/biokeramika_na_ osnove_ortofosfatov_kalciya_obzor/
15. Дубок В.А., Проценко В.В., Шинкарук А.В. и др. Новое поколение биоактивных керамик – особенности свойств и клинические результаты // Ортопед., травматол. и протезир. 2008. № 3. С. 91–95.
16. Инструкция по использованию «Алло-Гро» [Элек- тронный ресурс] // http://www.dental-azbuka.ru /articles/3-3/18-allogro_instr
17. Кирилова И.А. Костная ткань как основа осте- опластических материалов для восстановле- ния кости // Хирургия позвоночника. 2011. № 1. С. 68–74.
18. Кирилова И.А., Подорожная В.Т., Легостае- ва Е.В. и др. Костно-пластические биоматериалы и их физико-механические свойства // Хирургия позвоночника. 2010. № 1. С. 81–87.
19. Клинические и фундаментальные аспекты кле- точных и тканевых биотехнологий: М-лы II Все- рос. симп. с междунар. участием «Клинические и фундаментальные аспекты тканевой терапии» и конференции «Теория и практика клеточных биотехнологий». Самара, 2004.
20. Корж Н.А., Кладченко Л.А., Малышкина С.В. и др. Имплантационные материалы и остеогенез. Роль биологической фиксации и остеоинтегра- ции в реконструкции кости // Ортопед., травматол. и протезир. 2005. № 4. С. 118–127.
21. Корж Н.А., Радченко В.А., Кладченко Л.А. и др. Имплантационные материалы и остеогенез. Роль индукции и кондукции в остеогенезе // Орто- пед., травматол. и протезир. 2003. № 2. С. 150–157.
22. Королев С.Б., Абраменков А.Н. Новая медицин- ская технология подготовки костных транспланта- тов для костной пластики // М-лы II Московского междунар. конгр. травматологов и ортопедов. М., 2011.
23. Корочкин С.Б., Симонович А.Е., Кирилова И.А. и др. Использование имплантата-фиксатора в экс- перименте // Хирургия позвоночника. 2007. № 2. С. 71–76.
24. Матвейчук И.В., Денисов-Никольский Ю.И. Влияние процесса деминерализации на механиче- ские характеристики образцов компактной кости взрослого человека // Современные проблемы биомеханики: Вып. 4. Рига, 1987. С. 175–183.
25. Муслимов С.А. Морфологические основы при- менения аллогенных биоматериалов в регенера- тивной хирургии: Дис. … д-ра мед. наук. Уфа, 2000.
26. Новаченко М.П. Оперативное лечение так назы- ваемой местной фиброзной остеодистрофии у детей // Научная сессия, посвященная 100-летию со дня рождения Г.И. Турнера: Тез. докл. Л., 1959. С. 335–344.
27. Новое в решении актуальных проблем травмато- логии и ортопедии: Сб. науч. тр. М., 2000.
28. Проект федерального закона «О биомедицинских клеточных технологиях» [Электронный ресурс] // http://www.minzdravsoc.ru/docs/doc_projects/535 /vnesenie_Proekta_FZ_O_biomeditcinskih_ kletochnyh_tehnologiyah_26-02-2011.doc
29. Решетников А.Н. Оптимизация репаративной регенерации костной ткани при лечении лож- ных суставов с дефектами большеберцовой кости // Казанский медицинский журнал. 2005. № 1. С. 26–28.
30. Савельев В.И., Корнилов Н.В., Иванкин Д.Е. и др. Аллотрансплантация формалинизированной костной ткани в травматологии и ортопедии. СПб., 2001.
31. Савельев В.И., Родюкова Е.Н. Трансплантация костной ткани. Новосибирск, 1992.
32. Тер-Асатуров Г.П., Лекишвили М.В., Бигваева А.Т. и др. Сравнительное экспериментально-морфоло- гическое исследование эффективности биологиче- ских остеопластических материалов в замещении костных дефектов // Клеточная трансплантология и тканевая инженерия. 2012. № 1. С. 81–85.
33. Эппле М. Биоматериалы и биоминерализация. Томск, 2007.
34. Cornu O, Manil O, Godts B, et al. Neck fracture femoral heads for impaction bone grafting. Acta Orthop Scand. 2004; 75(3): 303–308. Литература 82 3/2012 (С. 72–83) Экспериментальные исследования ХИРУРГИЯ ПОЗВОНОЧНИКА И.А. Кирилова и др. Сравнительная характеристика материалов для костной пластики: состав и свойства
35. De Long WG, Einhorn TA, Koval K, et al. Bone grafts and bone graft substitutes in orthopaedic trauma surgery. J Bone Joint Surg Am. 2007; 89: 649–658.
36. Delloye C, Cornu O, Druez, et al. Bone allografts: what they can offer and what they cannot. J Bone Joint Surg Br. 2007; 89: 574–580.
37. Endobon. URL: http://fr.biomet.be/befr-medical/ befr-biomaterials/befr-endobon
38. Finkemeier CG. Current concepts review. Bonegrafting and bone-graft substitutes. J Bone Joint Surg Am. 2002; 84: 454–464.
39. Geistlich Biomaterials Matrix specialist for healthy and beautiful teeth. URL: http://www.geistlich. com/?dom=1005&rub=1074
40. Hubble MJ. Bone grafts. Surg Technol Int. 2002; 10: 261–265.
41. Implants for Life. FRIOS, the autologous way of bone regeneration. URL: http://www.dentsply-friadent.com/ ru/3295.htm.
42. King CB, Ball RY, Tucker JK. Autobanking of femoral heads for revision total hip replacement, a preliminary report of a new surgical technique. Surgeon. 2004; 2(1): 37–41.
43. Schmitt JM, Buck DC, Joh SP, et al. Comparison of porous bone mineral and biologically active glass in critical-sized defects. J Periodontol. 1997;68: 1043–1053. 44. Shors EC. The development of coralline porous ceramic bone graft substitutes. In: Laurencin CT, editor. Bone Graft Substitutes. West Conshohocken, PA: ASTM International, 2003: 271–288.
45. Subramanian S, Jain KD, Sreekumar R, et al. Early results of whole femoral head allograft with articular cartilage for acetabular impaction grafting in revision hip replacements. Ann R Coll Surg Engl. 2010; 92: 27–30.
46. Vallet-Regi M, Gonzalez-Calbet JM. Calcium Phosphates as Substitution of Bone Tissues. Progress Solid State Chem. 2004; 32: 1–31. 47. Yuan H, de Bruijn JD, Zhang X, et al. Bone induction by porous glass ceramic made from Bioglass (45S5). J Biomed Mater. Res. 2001; 58: 270–276. References
1. Proceedings of the International Scientific and Practical Conference Topical Problems of Implantology in Traumatology and Orthopaedics. Grodno, 2000. In Russian.
2. Proceedings of the IIIrd All-Russian Symposium with international participation Topical Problems of Tissue and Cell Transplantology. Moscow, 2007. In Russian.
3. Proceedings of the Vth All-Russian Symposium with international participation Topical Problems of Tissue and Cell Transplantology. Ufa, 2012. In Russian.
4. Proceedings of the International Scientific Conference Topical Problems of Traumatology and Orthopaedics in the Third Millennium. Omsk, 2000. In Russian.
5. Ardashev IP, Grigoruk AA, Plotnikov GA, et al. [Possible complications of autograft harvesting from the iliac crest]. In: Modern Technologies in Traumatology and Orthopaedics. Moscow, 1999: 191–192. In Russian.
6. Ardashev IP, Podorozhnaya VT, Kirilova IA, et al. [Experimental anterior fusion]. Hir Pozvonoc. 2008; (1): 66–73. In Russian.
7. Artyushkevich AS. [Agents and surgical methods to stimulate reparative processes in periodontal tissues]. URL: http://bone-surgery.ru/view/sredstva_i_hirurgicheskie_sposoby_stimuliruyuschie_reparativnye_ processy_v_. In Russian.
8. Barinov SM, Komlev VS. [Calcium Phosphate Based Bioceramics]. Moscow, 2005. In Russian.
9. Bezzubik SD, Grechuha AM. [Experimental foundation for application of bioactive glass-ceramic material Biositall-11 for substitution of mandibular bone defects]. Stomatologiya. 2009; (3): 26–28. In Russian.
10. Belozerov MN. [Evaluation of osteoplastic properties of various biocomposite materials for filling jawbones’ defects]. Candidate of Medicine Thesis. Moscow, 2004. In Russian.
11. Berchenko GN, Kesyan GA, Urazgildeev RZ, et al. [Comparative experimental morphological study of the impact of some calcium phosphate materials used in traumatology and orthopaedics on activation of reparative osteogenesis]. Byulleten’ Vostochno-Sibirskogo Nauchnogo Tsentra Sibirskogo Otdeleniya Rossiyskoy Akademii Meditsinskih Nauk. 2006; (4): 327–332. In Russian.
12. [Biomatrix]. URL: http://bioimplantat.ru/biomatrix. html. In Russian.
13. Grigoryants LA, Zuev DV, Badalyan VA, et al. [Surgical treatment of radiculo-dental cysts in jaws using ultrahigh dispersed hydroxyapatite without apicectomy]. Clinical Dentistry. 1997; (3): 54–58. In Russian.
14. Dorozhkin SV. [Bioceramics based on calcium orthophosphates]. URL: http://bone-surgery.ru/view/biokeramika_na_osnove_ortofosfatov_kalciya_obzor/. In Russian.
15. Dubok VA, Protsenko VV, Shinkaruk AV, et al. [A new generation of bioactive ceramics: peculiarities of their properties and clinical results.]. Ortopediya, Travmatologiya i Protezirovanie. 2008; (3): 91–94. In Russian.
16. [Instruction on the use of «Allo-Gro»]. URL: http:// www.dental-azbuka.ru/articles/3-3/18-allogro_instr. In Russian.
17. Kirilova IA. [Bone tissue as a basis of osteoplastic materials for bone structure restoration]. Hir Pozvonoc. 2011; (1): 68–74. In Russian.
18. Kirilova IA, Podorozhnaya VT, Legostaeva EV, et al. [Osteoplastic biomaterials and their physical and mechanical properties]. Hir Pozvonoc. 2010; (1): 81–87. In Russian.
19. Proceedings of the IInd All-Russian Symposium with International participation Clinical and Basic Research Aspects of Tissue Therapy and the Conference Theory and Practice of Cell Biotechnologies. Samara, 2004. In Russian.
20. Korzh NA, Kladchenko LA, Malyshkina SV, et al. [Implant materials and osteogenesis]. Ortopediya, Travmatologiya i Protezirovanie. 2005; (4): 118–127. In Russian.
21. Korzh NA, Radchenko VA, Kladchenko LA, et al. [Implantation materials and osteogenesis. The role of induction and conduction in osteogenesis]. Ortopediya, Travmatologiya i Protezirovanie. 2003; (2): 150–157. In Russian.
22. Korolev SB, Abramenkov AN. [New medical technology for preparing bone grafts for bone grafting]. Proceedings of the II Moscow International Congress of Traumatologists and Orthopedists. Moscow, 2011. In Russian.
23. Korochkin SB, Simonovich AE, Kirilova IA, et al. [Experimental spinal fusion with multipurpose deproteinized bone allograft]. Hir Pozvonoc. 2007; (2): 71–77. In Russian.
24. Matveychuk IV, Denisov-Nikolsky YuI. [The influence of demineralization process on mechanical characteristics of adult human compact bone specimens]. In: The Mechanics of Biological Tissue Substitutes: Vol. 4. Riga, 1987: 175–183. In Russian.
25. Muslimov SA. [Morphological Basis for the Use of Allogenic Biomaterials in Regenerative Surgery]. Doctor of Medicine Thesis. Ufa, 2000. In Russian.
26. Novachenko MP. [Surgical treatment of so-called local fibrous osteodystrophy in children]. Proceedings of the Scientific Session Devoted to the Centenary of the Birth of G.I.Turner. Leningrad, 1959: 335–344. In Russian.
27. [What’s New in the Topical Problem Solution in Traumatology and Orthopaedics]. Moscow, 2000. In Russian.
28. [A draft of the Federal law on Biomedical Cell Technologies]. URL: http://www.minzdravsoc.ru/docs/ doc_projects/535/vnesenie_Proekta_FZ_O_biomeditcinskih_kletochnyh_tehnologiyah_26-02-2011.doc. In Russian.
29. Reshetnikov AN. [Optimization of reparative regeneration of bone tissue in the treatment of false joints for defects of the tibia]. Kazanskiy meditsinskiy zhurnal. 2005; (1): 26–28. In Russian.
30. Savelev VI, Kornilov NV, Ivankin DE, et al. [Allografting of Formalinized Bone Tissue in Traumatology and Orthopaedics]. St. Petersburg, 2001.
31. Savelev VI, Rodyukova EN. [Bone Tissue Transplantation]. Novosibirsk, 1992. In Russian. 83 ХИРУРГИЯ ПОЗВОНОЧНИКА Экспериментальные исследования 3/2012 (С. 72–83) И.А. Кирилова и др. Сравнительная характеристика материалов для костной пластики: состав и свойства
32. Ter-Asaturov GP, Lekishvili MV, Bigvaeva AT, et al. [Comparative experimental morphological study of the efficacy of biological osteoplastic materials in bone defect substitution]. Cell Transplantation and Tissue Engineering. 2012; (1): 81–85. In Russian.
33. Epple M. [Biomaterials and Biomineralization]. Tomsk, 2007. In Russian.
34. Cornu O, Manil O, Godts B, et al. Neck fracture femoral heads for impaction bone grafting. Acta Orthop Scand. 2004; 75(3): 303–308.
35. De Long WG, Einhorn TA, Koval K, et al. Bone grafts and bone graft substitutes in orthopaedic trauma surgery. J Bone Joint Surg Am. 2007; 89: 649–658.
36. Delloye C, Cornu O, Druez, et al. Bone allografts: what they can offer and what they cannot. J Bone Joint Surg Br. 2007; 89: 574–580.
37. Endobon. URL: http://fr.biomet.be/befr-medical/ befr-biomaterials/befr-endobon
38. Finkemeier CG. Current concepts review. Bone-grafting and bone-graft substitutes. J Bone Joint Surg Am. 2002; 84: 454–464.
39. Geistlich Biomaterials Matrix specialist for healthy and beautiful teeth. http://www.geistlich. com/?dom=1005&rub=1074
40. Hubble MJ. Bone grafts. Surg Technol Int. 2002; 10: 261–265.
41. Implants for Life. FRIOS, the autologous way of bone regeneration. URL: http://www.dentsply-friadent.com/ ru/3295.htm.
42. King CB, Ball RY, Tucker JK. Autobanking of femoral heads for revision total hip replacement, a preliminary report of a new surgical technique. Surgeon. 2004; 2(1): 37–41.
43. Schmitt JM, Buck DC, Joh SP, et al. Comparison of porous bone mineral and biologically active glass in critical-sized defects. J Periodontol. 1997;68: 1043–1053.
44. Shors EC. The development of coralline porous ceramic bone graft substitutes. In: Laurencin CT, editor. Bone Graft Substitutes. West Conshohocken, PA: ASTM International, 2003: 271–288.
45. Subramanian S, Jain KD, Sreekumar R, et al. Early results of whole femoral head allograft with articular cartilage for acetabular impaction grafting in revision hip replacements. Ann R Coll Surg Engl. 2010; 92: 27–30. 46. Vallet-Regi M, Gonzalez-Calbet JM. Calcium Phosphates as Substitution of Bone Tissues. Progress Solid State Chem. 2004; 32: 1–31. 47. Yuan H, de Bruijn JD, Zhang X, et al. Bone induction by porous glass ceramic made from Bioglass (45S5). J Biomed Mater. Res. 2001; 58: 270–276.
Адрес для переписки: Кирилова Ирина Анатольевна 630091, Новосибирск, ул. Фрунзе, 17, НИИТО, IKirilova@niito.ru Статья поступила в редакцию 28.05.2012 И.А. Кирилова, д-р мед. наук; М.А. Садовой, д-р мед. наук, проф.; В.Т. Подорожная, канд. мед. наук, Новосибирский НИИ травматологии и ортопедии. I.A. Kirilova, MD, DMSc; M.A. Sadovoy, MD, DMSc, Prof.; V.T. Podorozhnaja, MD, PhD, Novosibirsk Research Institute of Traumatology and Orhtopaedics.
-
Оценка влияния остео-пластических материалов на регенерацию костной ткани после операции цистэктомии с резекцией апекса корня
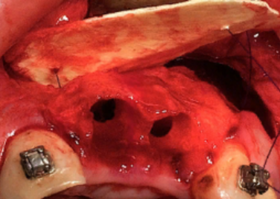 Клинико-экспериментальное исследование. Эффективность применения деминерализованной спонгиозы "Лиопласт-С"® и синтетического материала «CrossBone»® с помощью КТ
Подробнее
Клинико-экспериментальное исследование. Эффективность применения деминерализованной спонгиозы "Лиопласт-С"® и синтетического материала «CrossBone»® с помощью КТ
Подробнее
-
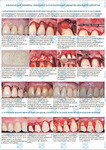
Применение костных аутотрансплантатов и индивидуальных аллогенных костных блоков при атрофии альвеоляра нижней челюсти
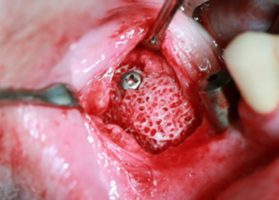 Файл статьи Клинико-экспериментальное исследование. Применение индивидуальных костных аллоблоков для реконструкции челюстей. Отработка хирургической методики. Сравнение с аутоблоками.
Подробнее
Файл статьи Клинико-экспериментальное исследование. Применение индивидуальных костных аллоблоков для реконструкции челюстей. Отработка хирургической методики. Сравнение с аутоблоками.
Подробнее
-
Оптимизация остеопластичес-кой коррекции атрофирован-ного альвеоляра челюсти. Клинико-экспериментальное исследование
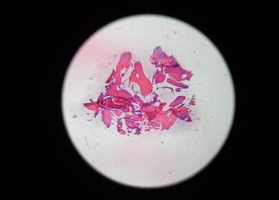 Цель исследования — разработка но-вого комплекса оперативной коррек-ции атрофированных альвеоляров челюстей для дентальной имплантации и протезирования
Подробнее
Цель исследования — разработка но-вого комплекса оперативной коррек-ции атрофированных альвеоляров челюстей для дентальной имплантации и протезирования
Подробнее
-
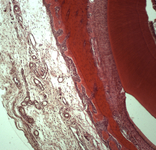
Морфологическое и лабора-торное обоснование приме-нения комбинированных трансплантатов при костной пластике челюстей
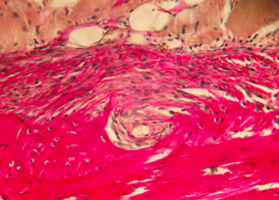 Экспериментальное исследование. Изучение морфогенеза после заме-щения дефектов нижней челюсти смесью лиофилизированной алло-спонгиозы и “аллогенного гидроксиапатита” в соотношении 1:1 и 3:1.
Подробнее
Экспериментальное исследование. Изучение морфогенеза после заме-щения дефектов нижней челюсти смесью лиофилизированной алло-спонгиозы и “аллогенного гидроксиапатита” в соотношении 1:1 и 3:1.
Подробнее